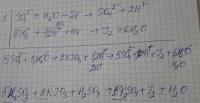Заряночка
Пользователи-
Постов
182 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Весь контент Заряночка
-
может метиленциклопропан? )
-
Да, это их ответы. Как я понимаю, растворимость показывает, какая максимальная масса вещества может раствориться в 1000 или 100 г воды при данной температуре.
-
-
Ответ: m(кристаллогидрата)= 248х= 21,824г, m (воды)= 18,558г. Масса третьего раствора равна 175,38г, объем его равен 118,5мл
-
-
M_GM, доброе время суток! Я же не на олимпиаде сижу. Задача за прошлый год. Хочу разобраться. А потом сама начала бы решать.
-
Растворимость пентагидрата тиосульфата натрия в воде при 00С равна 82,42г. Какие массы данного кристаллогидрата и воды необходимо взять для получения раствора, насыщенного при 0ºС, чтобы при его сливании со 100 мл 70%-ного раствора (ρ = 1,65 г/мл), насыщенного при 70ºС, был получен третий раствор, из которого при 50ºС (массовая доля соли в насыщенном растворе равна 62,92%) можно выделить 30,0 г пентагидрата тиосульфата натрия? Какова масса и объем полученного насыщенного раствора при 500 С. Плотность третьего раствора принять равной 1,48 г/мл. Это олимпиадная задача. Не смогли бы кто-нибудь подробное решение написать? Спасибо.
-
Скажите, пожалуйста, какая реакция верна? 1. 2KMnO4 + KI + H2O = KIO3 + 2MnO2 + 2KOH 2. 2KMnO4 + 6KI + 4H2O = 8KOH + 2MnO2 + 3I2 3. 2KMnO4 +KI + H2O = KIO + MnO2 + KOH. От чего зависят продукты реакции?
-
Спасибо вам большое! Я тоже так думаю. Но это вопрос ЕГЭ(
-
Даны: 1)N, 2)Be, 3)B, 4) AI, 5) P какие из указанных в ряду элементов образуют катионы, которые могут иметь электронную конфигурацию внешнего энергетического уровня ns2np1? Не понимаю, кто может подробно объяснить?
-
Электролиз K2SеO3. Я пишу для расплава так: K2SеO3 = 2K+ + SеO32- на катоде: K+ + 1е = К0 *2 на аноде: SеO32- -2e = SeO3 суммарное: 2K+ + SeO32- = 2К0 + SeO3 уравнение электролиза: K2SeO3 = 2К + SeO3 для раствора: K2SеO3- среда раствора щелочная. K2SеO3 = 2K+ + SeO32- Н2О = Н+ + ОН- на катоде 2Н2О + 2е = Н2↑ + 2ОН- *2 на аноде: 4ОН- - 4е = О2↑ + 2Н2О; (в щелочной среде) суммарное: 4Н2О + 4ОН- = 2Н2↑ + 4ОН- + О2↑ + 2Н2О уравнение электролиза: 2Н2О + 2Н2↑ = О2↑ Почему тут раствор рассматривается совсем по-другому? Где я ошибаюсь? Помогтье, пожалуйста!
-
Электролиз K2SеO3. Я пишу для расплава так: K2SеO3 = 2K+ + SеO32- на катоде: K+ + 1е = К0 *2 на аноде: SеO32- -2e = SeO3 суммарное: 2K+ + SeO32- = 2К0 + SeO3 уравнение электролиза: K2SeO3 = 2К + SeO3 для раствора: K2SеO3 - среда раствора щелочная. K2SеO3 = 2K+ + SeO32- Н2О = Н+ + ОН- на катоде 2Н2О + 2е = Н2↑ + 2ОН- *2 на аноде: 4ОН- - 4е = О2↑ + 2Н2О; (в щелочной среде) суммарное: 4Н2О + 4ОН- = 2Н2↑ + 4ОН- + О2↑ + 2Н2О уравнение электролиза: 2Н2О + 2Н2↑ = О2↑ Почему тут раствор рассматривается совсем по-другому? Где я ошибаюсь? Помогите, пожалуйста!
-
Вот так можно написать: H2ZnO2 + CaCO3 = CaZnO2 + H2O + CO2 ?
-
Вот в этом вопросе ответ: 5312. Вопрос: Разве Zn(OH)2 реагирует c CaCO3 ? Если да, то как написать уравнение?
-
Очень интересная дискуссия получилась) Не зря сказано, что в споре рождается истина. Много для себя поняла. Я просто привыкла уравнивать методом полуреакции, так легче для меня. А на егэ быстро переведу на ЭБ. Эб не так быстро получается у меня. Поэтому хотелось добить до конца, почему не получается. Теперь поняла, оказывется, остаток. что не получается , нужно перепроверить и подбирать самим допускается. Спасибо большое всем!
-
Это я тоже поняла, но мне именно электронно-ионным методом нужно уравнять!
-
Согласна. Тогда где ошибка в полуреакции? Получается, полуреакция правильна, а уравниваем в конце методом подбора?))
-
Задание такое: Для выполнения задания используйте следующий перечень веществ: сульфит калия, йодат калия, серная кислота, сульфат калия, сульфид серебра. Допустимо использование водных растворов веществ. Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель. Может у меня уравнение реакции неправильное? Пробовала исправить, теперь не уравнивается калий.
-
-
KIO3 + K2SO3 + H2SO4 = что получается и как уравнять электронно-ионным методом? Я пробовала написать уравнение так: KIO3 + K2SO3 + H2SO4 = I2 + K2SO4 + H2O только у меня не получается уравнять методом полуреакции. А методом электронного баланса получается так: 2KIO3 + 5K2SO3 + H2SO4 = I2 + 6K2SO4 + H2O
-
Из предложенного перечня веществ: аммиак, феррат железа, серная кислота, гидроксокарбонат меди(II), сульфат калия выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Допустимо использование водных растворов веществ. Я даже не нашла как пишется формула феррата железа(... Ферраты калия, натрия есть, а железа не могу найти. Еще не указана степень окисления его. Если предположить, что Fe(II), то думала, что FeFeO2. А как написать ОВР?
-
Спасибо всем большое! А это нужно ведь для ЕГЭ!!) Очень понятное объяснение для егешника! Спасибо! ссылку неправильно написала. вот тут: https://reshimvse.com/zadacha.php?id=4321