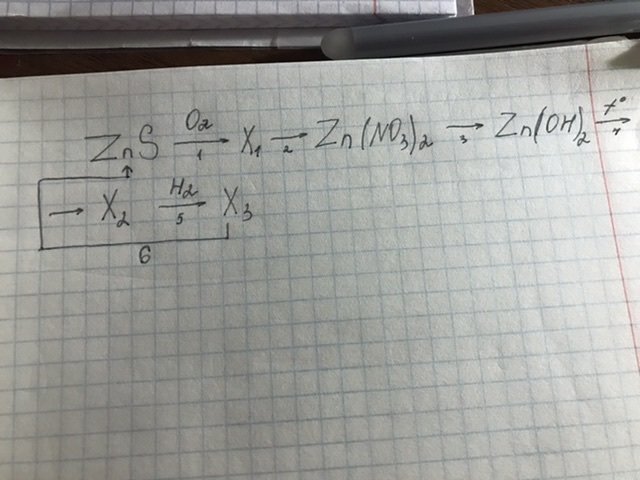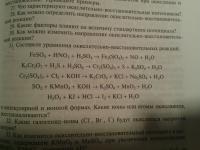Поиск
Показаны результаты для тегов 'овр'.
Найдено 125 результатов
-
1. NH4NO2=N2+H2O 2. HAuCl4+SbH3=Au+HCl+SbOCl3 3. C6H12O6+CuCl2+NaOH=C6H11O7Na+Cu2O+NaCl 4. Na[Cr(OH)4]+Cl2+NaOH=Na2CrO4+NaCl+H2O
-
Помогите с задачами, пожалуйста Буду очень благодарна!!!!
-
- химия
- общая химия
- (и ещё 3 )
-
Привет, подскажите, пожалуйста, может ли окислить сернистый газ аммиак. идет ли подобная овр реакция? Заранее спасибо
- 3 ответа
-
- аммиак
- сернистый газ
-
(и ещё 1 )
C тегом:
-
Надо решить методом электронного баланса: 1) PbS+H2O2=PbSO4+H2O 2) CrCl3+H2O2+NaOH=Na2CrO4+NaCl+H2O Заранее спасибо!
-
-
K⁰ + H+¹N+⁵O₃⁻² = K+¹N+⁵O₃⁻² + N¯³H₃⁺¹ + H₂⁺¹O-² K⁰ - 1ē -> K+¹ │1│8 N+⁵ + 8ē -> N¯³ │8│1 8K + 9HNO₃ = 8KNO₃ + NH₃ + 3H₂O Добрый день! Никак не могу понять, почему не уравнивается водород? Слева 9 справа 8? Или не нужно уравнивать его? Тут такая же история только с кислородом слева 8 справа 13... P + HNO3 = NO2 + H3PO4 + H2O P0 -5ē -> P+5 | 1 N+5 +1ē -> N+4 |5 P + 5HNO3 = 5NO2 + H3PO4 + H2O Насколько помню из школы все должно уравниваться?
-
Добрый вечер. Необходимо уравнять методом ионного баланса. Вычислить ЭДС NaOCl+KI+H2SO4 (стрелка) I2+K2SO4+NaCl+... Я делал так: Na+OCl+K+I+2H+SO4 (стрелка) 2I+2K+SO4+Na+Cl+... OCl+I+2H (стрелка) 2I+Cl OCl+2H+2e (стрелка) Cl+H2O - восстановление 2I-2e (стрелка) I2 - окисление OCl+2H+2I (стрелка) Cl+H2O+I2 NaOCl+2KI+H2SO4(стрелка) I2+K2SO4+NaCl+H2O ЭДС. Не могу найти стандартный электродный потенциал для OCl
-
Добрый вечер. Необходимо уравнять методом ионного баланса. Вычислить ЭДС NaOCl+KI+H2SO4 (стрелка) I2+K2SO4+NaCl+... Я делал так: Na+OCl+K+I+2H+SO4 (стрелка) 2I+2K+SO4+Na+Cl+... OCl+I+2H (стрелка) 2I+Cl OCl+2H+2e (стрелка) Cl+H2O - восстановление 2I-2e (стрелка) I2 - окисление OCl+2H+2I (стрелка) Cl+H2O+I2 NaOCl+2KI+H2SO4(стрелка) I2+K2SO4+NaCl+H2O ЭДС. Не могу найти стандартный электродный потенциал для OCl
-
2CuSO4+4KI = 2CuI+I2+K2SO4 Казалось бы, обыкновенные два вещества растворимых в воде, при воображаемой реакции ионного обмена, в растворе бы наступило ионное равновесие, а нет, здесь ОВР с медью окислителем и йодом восстановителем (прошу прощения если перепутал окислителя с восстановителем). Не мог бы кто нибудь мне растолковать на привычном для него языке в плане терминологии (я пойму) механизм этой реакции? Что является её инициатором? У меня есть теория, что так как сульфат меди дает в растворе кислую среду вследствие гидролиза, а йодид калия нейтрален, то общая среда раствора при смешивании будет кислая, что и провоцирует данную реакцию. И все же желал бы более профессионального ответа.
-
Помогите пожалуйста уровнять методом полуреакций. Первые два я вроде бы сделала, но коэффициенты не подходят, а в чем ошибка понять не могу. А последние даже как делить на ионы не понятно(
-
Используя метод полуреакций, составить уравнение ОВР и расставить коэффициенты Zn + KNO3 + ... --> NH3↑ + K2[Zn(OH)4]
-
MnO2 + K2O + H2SO4 → MnSO4 +O2 + K2SO4 + H2O помогите, пожалуйста, решить методом полуреакций, заранее спасибо!!!
-
Как записывается в ОВР оксоний MnO4^- + H3O^+ + H2O2 ? Нашел лишь равнозначность H3O^+ = H^+ + H2O , то есть запись должна быть следующей (?) : К примеру: KMnO4 + HCl + H2O + H2O2 ,но в итоге ОВР слишком замудренная. Можно ли записывать к примеру след. образом : KMnO4 + H3O(OH) + H2O2 , в итоге все уравнивается, но уверенность в этом крайне мала.
-
В общем, не могу составить полуреакцию с карбидом марганца (Mn3C). Выглядит пока примерно так: Mn3C + HNO3 = /Mn2+,NO/ NO3-+4H++3e=NO+2H2O ---и тут должна быть вторая полуреакция--- Вообще, карбиды марганца реагируют с кислотами и водой. Так что реакция вроде должна пойти
-
1.) sncl2+hno2+hcl=sncl4+no+h2o 2.) na2seo3+cl2+naoh=na2seo4+nacl+h2o 3.) h2so3+cl2+h2o=h2so4+hcl
-
Помогите разобраться в окислительно восстановительной реакцией
Имир опубликовал тема в Решение заданий
Для следующих реакций укажите окислитель и восстановитель. Пользуясь методом электронного баланса, расставьте коэффициенты в уравнениях окислительно-восстановительных реакций. a) FeO + HNO3 → Fe(NO3)3 +NO + H2O b) KBrO + MnCl2 + KOH → KBr +MnO2 + KCl + H2O Заранее спасибо -
3 задания сделал, а 4 никак... 4.На основании Е0298 напишите уравнения полуреакций окисления и восстановления в ионно-электронной форме, определите коэффициенты и составьте правую часть уравнения реакции: а) MnO2+KBr+H2SO4(кислая среда) = б) HIO3+H2S= Прошк помогите
-
Добрый вечер. Подскажите, верны ли в этой реакции продукты. Fe(OH)2+Cl2+H2SO4=Fe2(SO4)3+HCl+H2O 2Fe(OH)2+Cl2+3H2SO4=Fe2(SO4)3+2HCl+4H2O Вроде бы даже и уравнялось, значит верно. Не хочу создавать отдельную тему. Правильно ли записан комплекс? [Ni(CN)4]- NO3-
-
реакция образования агрегата: 8KMnO4 + 3Na2S2O3 + H2O→ 8MnO2↓+ 3Na2SO4 + 3K2SO4 + 2KOH закончить реакцию образования стабилизатора: KMnO4 + Na2S2O3 + H2O→ MnSO4... Помогите решить задачу методом полуреакции
-
Для данной системы электронно-ионным методом записать уравнение реакции. Используя стандартные восстановительные потенциалы указать в каком направлении может протекать процесс. SnCl2+K2Cr2O7+HCl=SnCl4+... K2MnO4+FeCl2+HCl=FeCl3+...