alex_dnt9
Пользователи-
Постов
40 -
Зарегистрирован
-
Посещение
Весь контент alex_dnt9
-
-
Даже не знаю
-
гидролиз соли (NH4)2SeO4. весь инет перерыл, ничего нет, может тут кто-нибудь знает?
-
а не могли бы помочь с объяснением интенсивности коррозии? эдс ведь это разность потенциалов, и я не могу в двух случаях понять какие разности брать
-
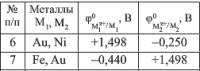
Определите, к какому типу относится покрытие, нанесенное на сталь (потенциал стали примите равным стандартному потенциалу железа φ(Fe(2+) /Fe) = -0,440 В). Напишите уравнения процессов, возникающих в случае разрушения покрытия: а) в морской воде, pH = 8; б) в воде системы отопления (деаэрированная среда). В какой среде коррозия протекает интенсивнее? Ответ подтвердите расчетом ЭДС коррозионного элемента,приняв активность ионов корродирующего металла равной 10^(‒6). к какому же типу покрытия будет относиться Сu нанесенная на Fe
-
смотрите какие у меня данные m=34,21г V=1л M=146г/моль T=298K посчитал молярную концентрацию, она равно 0,23 моль/л посчитал изотонический коэффициент, он равен 1,95. и дальше давление P=1,95*0,23*8,31*298=1110(ну а тут я поделил на 1000 и получил в обозначениях Дж/м^3- а это вроде как паскали, или все-таки нет?)
-
подскажите пожалуйста. задача на определение осмотического давления водного раствора электрлита. посчитал и получил 1,1 Па это норма? имею в виду не слишком ли маленькое?
-
такая вот штука у меня, дано Al(OH)3-->Al(3+)+OH-, это малорастворимое соединение. если я знаю общую молярную концентрацию ве-ва, то как найти концентраци Al(3+) и OH-? они же будут меньше общей концентрации, тк это малорастворимое соединение, верно?
-
если Fe нанесен Au
-
а для чего нам тогда кислотность дана? а если с учетом активностей, то куда ее "впихнуть"? нашел вот такую формулу для потенциала, где Z число электронов участвующих в реакции, но не могу понять в моем случае от что один?
-
только что прочитал в методичке что pH=-lg(a(H+)), т.е. логарифм от активности ионов. а чтобы их найти нужно применить ионную силу
-
вычислить электродный потенциал металла корродирующего во влажной аэрированной среде при температре 298 К и электродвижущую силу коррозионного элемента при извнстных значения активности металла дано Pb фо=-0,126 В а(Mz+)=0,0002 моль\дм^3 активность ионов металла pH=2,9 подскажите пожалуйста ход решения с формулами, если можно объясните что к чему, не хочу просто списывать, хочу хоть емного разобраться, за ранее спасибо))
-
а если так, Al(OH)3 ПР=[Al3+]*[OH-]^3? а как найти концентрацию гидроксид-ионов?
-
дано Al(OH2) молярная концентрация насыщенного раствора 6,78*10^-9 ПР=[Al3+]*3[OH-]=6,78*3*6,78=137,9. правильно ли использовал молярные концентрации? и вообще решение правильно?
-
дано ионное произведение воды K(H2O)=1*10^-14 электролит HCLO4 молярная концентрация водного раствора 7*10^-2 моль\дм^3 исходя их того что вычитал в интернете получилось небольшое решение исходя из уравнения диссоциации делаем вывод что концентрации иона водорода и самого электролита равны, поэтому рН=-lg(H+)=-lg(C(H+)*(сигма)) где сигма - находится по таблице. чтобы ее найти нужно найти ионную силу ионов водорода, ее я нашел она у мня равно 0,07, а дальше не могу найти подходящую таблицу, в каких то таблица значения коэффициента ближе к единице, в каких то ближе к нулю. не могу разобраться. может кто-нибудь помочь и заодно проверить решение? буду очень признателен))
-
определить скорость газофазной реакции по каждому компоненту
alex_dnt9 опубликовал тема в Решение заданий
определите скорость газофазной реакции по каждому компоненту, если известна скорость образования r какого-либо продукта реакция 2А-->В продукт В r, моль / (л ⋅ с) -- 2,4⋅10^-3 подскажите пожалуйста, как определить скорость, есть какая-нибудь формула, гугл не спасает -
ну само уравнение правильно составлено?
-
дана гетерогенная реакция A+B+C-->продукты известно что, если увеличть концентрации вещества в 2 раза, то скоростьреакции возрастет 2,83 раза, а при увеличении концентрации реагентов А и С скорость реакции не изменяется(все протекает при постоянной температуре) если при изменении концентрации веществ А и С, скорость реакции не изменяется, то в кинетическом уравнении их по идее вообще быть не должно? и подскажите как определить константу скорости в этом случае. или может есть какой то своеобразный ход решения? приблизительное уравнение верно? v=k*C^1.5 так? или можно еще как то найти константу?
-
сейчас зарплаты только так и повышают
-
рассчитать, во сколько изменится скорость реакции после того как прореагирует 70% N2O, если исходная концентрация этого вещества равна 2 моль/дм^2 проверьте решение пожалуйста дано уравнение 2N2O-->2N2+O2 скорость реакции равна V=k*C[A]^2 так как прореагирует 70% вещества, то концентрация увеличится в 0,3 раза, следовательно скорость реакци увеличится в 0,09 раз, правильно?
-
А почему равновесие? а разве не в 4-ом случае равновесие получается?