Маргарита Мастерова
Пользователи-
Постов
26 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Весь контент Маргарита Мастерова
-
Вначале было 2,368 моль HCl и 0,592 моль О2
-
Да, я сделала это. Затем приняла массу смеси за сто грамм и нашла общее количество моль смеси. Оно оказалось равно 2,958. Я рассчитала что 1 молекула=0,592 моль в этой реакции. И по стехиометрическим коэффициентам нашла количество вещества всех компонентов. n(HCl)=2,368, n(O2)=0,592, n(H2O)=n(Cl2)=1,184. Я не совсем понимаю, найденные величины являются теоретическими или практическими? Если теоретическими, то получается, что на практике было получено 0,592 моль хлора. Тогда соотношение будет 4:1:2:1, а в ответе ( 4:11:2:2).
-
Большое спасибо. Не могли бы Вы, пожалуйста, помочь ещё с этой задачей: При постоянном объёме и некоторой температуре в системе установилось равновесие 4HCl(г) + O2 (г) = 2 H2O(г)+ 2Cl2(г) Исходная смесь хлороводорода и кислорода имела относительную плотность по водороду, равную 16,9. Чему равно объёмное соотношение между реагентами в состоянии равновесия, если после его достижения выход хлора составляет 50 % от теоретического?
-
Я правильно понимаю, что с помощью этого метода я смогу подсчитать энтальпию ? И вычислить среднюю энтальпию ( искомая величина)
-
Объясните поподробнее, пожалуйста , я не знакома с такой формулой и не понимаю решения
-
Я не знаю ,с чего начать. Подскажите, пожалуйста
-
При постоянном объёме и некоторой температуре в системе установилось равновесие 4HCl(г) + O2 (г) = 2 H2O(г)+ 2Cl2(г) Исходная смесь хлороводорода и кислорода имела относительную плотность по водороду, равную 16,9. Чему равно объёмное соотношение между реагентами в состоянии равновесия, если после его достижения выход хлора составляет 50 % от теоретического?
-
При 500 К константа равновесия реакции Kс PCl5(г) =PCl3(г)+Cl2(г) равна 0,04. В сосуд ёмкостью 5 л было введено 0,2 моль PCl5 и 0,1 моль PCl3 . Вычислить: а) равновесный состав смеси; б) общее давление в сосуде в состоянии равновесия; в) равновесные парциальные давления компонентов в смеси.
-
-
Если вычислить моляльность раствора Pb(NO3)2*100H2O, то получится 0,556.энтальпия его образования дана
-
Энтальпия образования этого раствора дана в условии. Что дальше?
-
Вычислить энтальпию разбавления водного раствора нитрата свинца моляльности 0,556 до моляльности 0,111 по следующим данным:(см.фото) Методом интерполяции я высчитала, что энтальпия образования 0.111-молярного раствора будет равняться -418,4414 кДж/моль. Подскажите, пожалуйста, как продолжить решение этой задачи ?
-
Стандартное значение внутренней энергии реакции C2H6(г)+7/2O2(г)=2CO2(г)+3H2O(г) составляет -1560,9 кДж. Вычислить стандартную энтальпия указанной реакции при 298,15 К.(ответ -1559,7 кДж)
-
Развалится на какие элементы?
-
Скажите, пожалуйста, вещество, представленное на фотографии ниже, и вещество, упомянутое вами,- это одно и то же соединение? В чем разница ? И второй вопрос: пойдёт ли аналогичная реакция с HBr/HCl( хватит ли их силы), как будет проходить реакция с H2SO4? Большое спасибо за вашу помощь! Картинка , о которой я говорила
-
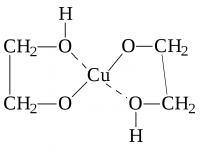
Назвать не менее двух примеров разрушения гликолята меди ( образованного при взаимодействии этиленгликоля с гидроксидом меди). Привести реакции
-
Co2+ И Cu2+ У кого больше радиус? Как определить?
-
Как изменяются радиусы атомов и ионов? Существуют ли какие либо закономерности? Сравните радиус Mn2+ и Ni2+.
-
Изобразить схему перекрывания орбиталей при образовании связей в молекуле углекислого газа, исходя из гибридных представлений
-
В следующих парах кислот и оснований указать более сильный электролит:H2SeO4 и H2SeO3, TlOH и Tl(OH)3
-
Изобразить схему перекрывания орбиталей при образовании связей в молекуле муравьиной кислоты , исходя из гибридных представлений.
-
Изобразить схему перекрывания орбиталей при образовании связей а молекуле HCN, исходя из гибридных представлений
-
Охарактеризовать валентные возможности атома сиборгия. Объяснить, почему существует XeF6 и почему не существует NeF6.