
Zhenya524
-
Постов
39 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Zhenya524
-
-
Спасибо)
-
Как назвать GaOHSeO3?
-
. Ваша правда, Бендера снова занесло. Простите великодушно, позор на седины. Всему виною грипп, наверное.
. Ещё раз приношу свои извинения.
. Нужно просто поделить ПР на 10^(-2).
. С уважением
P.S. Бред свой первоначальный поправил с Вашей помощью.
Спасибо огромное!!! И еще одну задачку пожалуйста помогите решить.
Надо рассчитать pH 0.100 М растовора фторида аммония.
Я попыталась решить, но дальше я не знаю как решать.

-
. 1) записываете ур-ние диссоциации хромата стронция, на его основе записываете выражение для ПР. Если не ошибаюсь, ПР(Sr(CrO4)2) = 4c^3, где с - молярная концентрация хромат-аниона (растворимость малорастворимого электролита в единицах молярной концентрации). Это, что называется, в равновесии над осадком (без других солей).
. 2) в 10 мМ р-ре хлорида стронция (сильного электролита), диссоциирующего нацело, диссоциацией малорастворимого хромата стронция можно пренебречь, т.к. равновесие практически полностью смещено в сторону недиссоциированной соли. Т.о. концентрация катиона стронция в данном растворе равна концентрации хлорида стронция (ур-ние диссоциации напишете), т.е. 10^(-2) моль/л.
. 3) чтобы найти искомую растворимость (равновесную концентрацию хромат-аниона) нужно величину ПР данной соли разделить на квадрат этой концентрации, т.е. на 10^(-4).
. В принципе, первые два шага - это только пояснение. Конкретный рассчёт в последнем пункте.
. С уважением
А разве хромат стронция не SrCrO4?
-
. Как написано в одной хорошей книжке: "Ищите и обрящите". На страничке http://www.xumuk.ru/encyklopedia/675.html имеется одна любопытная для Вас формула. Ежели найдёте, подставьте в неё табличные и исходные данные, проведите не Бог весть какой сложности арифметические вычисления, и будет Вам СЧАСТЬЕ, как говорится...
. Удачи!
Спасибо большое, все получилось!
А можете еще с одной задачкой помочь пожалуйста?
Надо определить растворимость хромата стронция в присутствии 10 мМ хлорида стронция
-
Определить соотношение компонентов ацетатного буферного раствора, имеющего рН = 5.2.
-
-
А в реакции магната калия с сульфитом калия и гидроксидом калия что получится?
-
(NH4)2CrO4+SnCl2=
Cl2+Be+NaOH=
Sn+H2SO4 конц=
Fe+HNO3 конц=
P+KOH+H2O=
Al+KOH+KClO=
Zn+KO+H2O=
SO2+K2CrO4+KOH=
KBrO4+KHS=
MnO2+SnSO4+H2SO4=
-
. ПР это константа для данной температуры. Формулу Вы правильно написали, но в растворе нитрата стронция, сильного электролита, диссоциирующего полностью, равновесная концентрация катиона стронция будет равной 0,005 моль/л. Это значение и надо подставить в формулу ПР, откуда найдёте равновесную концентрацию фосфат-аниона (корень квадратный из отношения ПР к 0,005^3).
. Не забудем полученное значение поделить пополам и - вуаля! - получаем искомую растворимость фосфата в растворе нитрата.
. Вот так как-то...
Спасибо большое.

-

. Для начала давайте определимся с растворимостью фосфата стронция в воде. Каковы Ваши мысли по этому поводу?
Но я не понимаю как найти расторимость в нитрате стронция
-
Во сколько раз расторимость фосфата стронция в воде превышает его раствормость в 0.005 м растворе нитрата стронция?


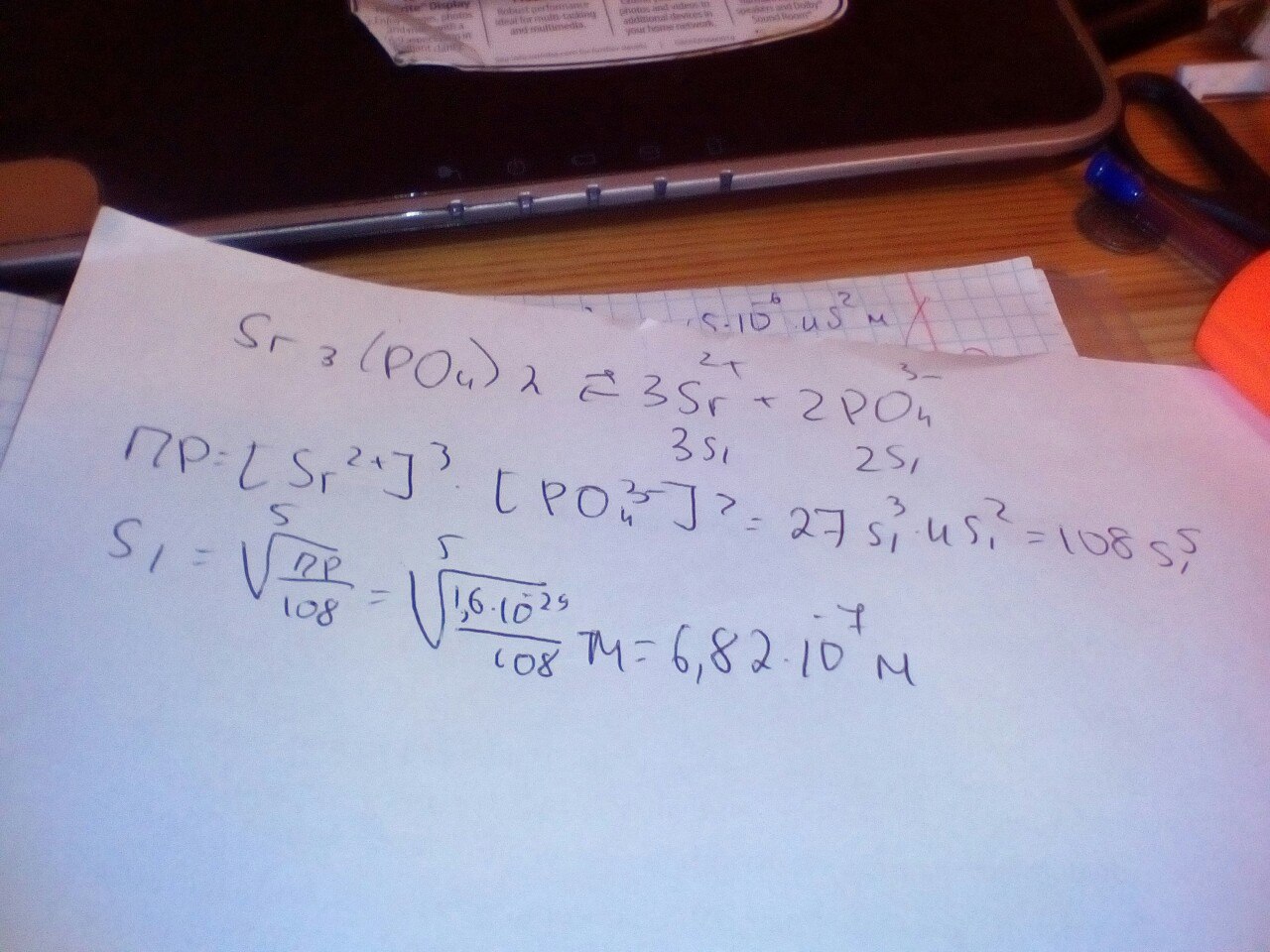
Аналитическая химия
в Решение заданий
Опубликовано
Что такое опыт со свидетелем?