
T1mi
-
Постов
11 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные T1mi
-
-
Судя по всему предсказать нельзя как такой себя порошок будет вести, можно только попробовать.
Собственно вопрос в получении электролита для дальнейшего эксперимента доступным способом.
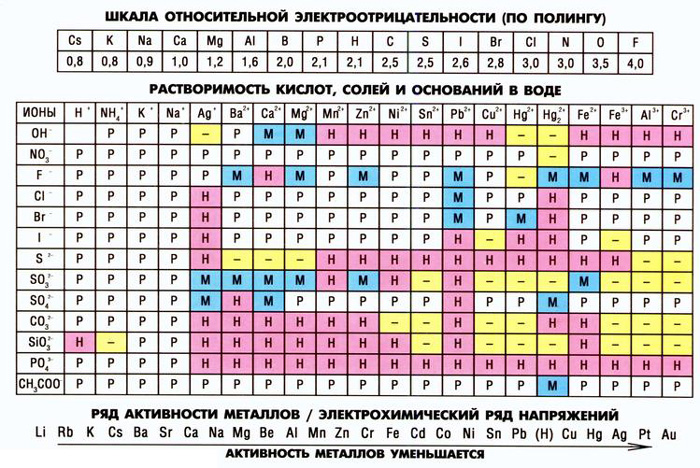
Растворять в щелочах - сомнительный способ, не ясно что там образуется(станнаты) и что дальше с этим делать. Да и долгий это процесс, возня с растворами. Я прикинул, можно исходить из следующих соображений.
Температура разложения(Tрз) оксидов металлов высока > 800C.
Tрз нитратов низка: CuNO3 - 170C, Pb(NO3)2 - 200C. Поэтому нитрат моно получить только в водном растворе.
Tпл солей: CuCl2 - 630C, CuSO4 - 653C.
Tпл припоя ПОС60 - 190С.
Значит можно реакции провести быстро и удобно в расплаве припоя.
A) CuCl2 + Me(Pb/Sn) = MeCl2 + Cu
B) CuSO4 + Me = MeSO4 + Cu
Должен получится сплав хлоридов или сульфатов и меди. Во втором случае может реакция как то иначе пойдёт ?
Если сделать то же с Cuo:
CuO + Me = MeO + Cu
Тогда далее плав можно в случае A/B растворить в нитрате(каком, что бы не образовались станнаты ?) что бы реакцией обмена получить раствор нитратов, при этом медь останется в осадке.
Как из MeCl2 получить нитрат не ясно(+ Fe(NO3)2) получатся нитраты-Me и FeCl3, который растворим и как его отделить ??), так как все нитраты растворимы, то реакция обмена не пойдёт, например с KNO3 ?
Что с оксидом делать не знаю, что бы очистить от меди. Если растворить в уксусе, слабой концентрации, то свинец наверно растворится, а олово нет, так как ацетат его разлагается в воде. Возможно можно использовать лимонную кислоту, так как вроде бы как оба цитраты растворимы, но это нужно в каком то справочнике искать их свойства..
-
Цитата
Я имею ввиду что если напрямую сплав растворить не получается, то может через промежуточные реакции соли получить, например окислить и оксид в соль перегнать, в кислоте растворить. Он же наверно лучше растворим, чем исходный металл ?
CuCl2 + Pb = PbCl2 + Cu↓
CuCl2 + Sn = SnCl2 + Cu↓Это значит что сразу на поверхности припоя появится не растворимый слой хлоридов и процесс заглохнет ?
А если то же самое сделать с нитратом/ацетатом меди ?
И есчо надо посмотреть что с цитратами, они растворимы Pb/Sn ?
-
Почему проблема, это ведь зависит от отношения процентного в электролите ?
ЦитатаH2SiF6 или HBF4, но можно еще HClO4 или разбавленной HNO3
Где же такие реагенты найти, а попроще разве никак ?
Свинец например жидкой с серой хорошо реагирует, если припой с ней например сплавить, потом сульфиды растворить чем..
Или может окислить, термит например сделать на оксиде меди, получится такое ?
-
-
-
-
Невозможно реализовать.
Обычный ПОС, допустим пос-60(Sn 60%, Pb 40%).
Цитатабор фтористые эл.
Такие добыть не могу.
-
Тоесть тем же электролизом ?
Если посмотреть растворимость

Получается растворимы нитрат и ацетат, либо нужно смешивать разные соли. Тоесть если взять раствор селитры и элетролизить на электродах из припоя, они растворятся ?
Сомневаюсь, там наверно всякие оксиды/гидроксиды будут получаться, налётом электрод покроется не растворимым..
-
-
Здравствуйте.
Прошу помочь со следующей задачей.
Хочу сделать паяльную пасту. Для этого нужна пыль из припоя.
Я поискал по патентам, есть несколько, самый простой этот http://www.freepatent.ru/patents/2483143
Для электролиза нужен раствор солей припоя как понимаю. Водорастворимых солей неорганических.
В этом патенте http://www.findpatent.ru/patent/258/2585508.html используется органический электролит:
Цитата2% стеарата олова и 1,2% стеарата свинца в этиленгликоле
Учитывая что этг токсичен, то этот способ мне не подходит, да и сложный.
Вопрос как получить соли из припоя, причём сделать это с использованием доступных в быту реагентов.
Я поискал по аффинажу и растворителям припоя, судя по всему ничего доступного нет.
Если попробовать получить соли сплавлением припоя, допустим с селитрой или с какими либо иными веществами ?
Электролит из припоя.
в Электрохимия
Опубликовано
Поискал подробнее, есть пример плава Sn + NH4CL: https://www.youtube.com/watch?v=2y2OWmnJTtU
Так же нашёл пример плава PbO + NH4NO3. Так что по идеи должно получиться. Более подробно:
A)
1. Плав: CuSO4 + Me = MeSO4 + Cu↓
2. Отмываем исходный сульфат водой.
3. MeSO4(избыток) + Ca(NO3)2 = MeNO3 + CaSO4↓
4. Упариваем в насыщенный раствор что бы был минимум сульфата.
B)
1. Плав: CuCl2/CuCl + Me = MeCl2 + Cu↓
2. MeCl2 + CuSO4 = MeSO4↓ + CuCl2
При этом может пойти реакция Cu + CuCl2 -> 2CuCl↓, значит использовать хлорид не желательно.
Тогда вместо сульфата можно взять (NH4)2SO4.
С)
Плав: (NH4)2SO4 + Me = MeSo4 + ..
D)
Плав; Me + CuO = Cu + MeO
Затем оксид + нитрат.
Пока решил проверить вариант A. Купил в магазе удобрений кальциевую селитру и медный купорос. Не повезло пока с погодой.
Для второго варианта использую тот же купорос:
2CuSO4 + 2NaCl + SO2 + H2O = 2CuCl↓ + 2H2SO4 + Na2SO4
И никаких извращений с щелочами и уксусами