
eirena
Пользователи-
Постов
175 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Весь контент eirena
-
Добрый день) Помогите составить полуреакции для следующей реакции: NH3 + KClO3 + KOH = KCl + KNO3 + H2O. Электронным балансом все уравнивается. но вот электронно - ионным не получается..... так в полуреакции NH3 + ОН ----- NO3 + Н2О не выходит уравнять атомы....
-
Скажите пожалуйста, можно ли в ниже приведенном уравнении расставить коэффициенты кислородно-водородным методом? Что то вместо 8ми 10 получается....
-
В чем отличие растворимости от коэффициента растворимости? В обоих случаях в определениях учебников это масса вещества растворенная или в 100 г растворителя при определенных условиях или в одном литре растворителя также при указанных условиях. Последнее относят к понятию КР, но также есть формулы , в которых КР это отношение массы вещества к 100 г. и это полностью совпадает с растворимостью.
-
Скажите пожалуйста, при окислении формальдегида конечным продуктом будет углекислый газ или карбонат аммония? Или продукт зависит от количественных соотношений реагентов?
-
-
Добрый день. Скажите пожалуйста, почему в в этой реакции баланс рассчитывается с учетом изменения СО углерода (с железом понятно)? Разве не азот меняет СО?
-
Выходит у меня путаница с расчетами по Нернсту....
-
-
Судя по всему да.. Пока у меня 119 г гидрата получается.... В итоге получилось (не у меня) вот такое решение: Пусть х - масса квасцов, У - масса воды. Тогда: 24.8\124.8=(258х\474) : (Х+У). Также: 4/104=(258х\474 -0.2 умн на 258) : ( х+у - 0.2умн на 474). решаем систему и получается х - 109.25 и у - 189.99. Почему такая растворимость, остается загадкой.... Может позже прояснится(((
-
Судя по всему да.. Пока у меня 119 г гидрата получается....
-
Да....109.4 кристаллогидрата и 190.1 мл воды(((( МГУшная книжка.... Решения там нет...Просто сначали дали задачу в электронном виде, а уже потом нашли источник.
-
Нашлись ответы. не решение пока... 190.1 мл воды((((
-
Помогите, пожалуйста разобраться с решением отмеченной красным задачей. Пытаюсь решить через систему уравнений, но постоянно разные ответы(( растворимость соли при 60 - 24.8г, при 10 градусах - 4г
-
Подскажите, пожалуйста, как из тетрабората(III) натрия получить перборат(III) натрия? Это часть цепочки... У Третьякова не найдена реакция.. Сама цепочка: B2O3 ---- NaOH р-р,изб ---- Na2H4B2O8. там скорее всего тетрагидроксоборат будет...
-
а почему 12 ионов водорода?
-
Добрый день! Можно попросить помочь составить ЭИ баланс вот для этого уравнения: 2LiAlH4 + 12H2SO4 → Li2SO4 + Al2(SO4)3 + 8SO2 + 16 H2O ? Коэффициэнты сейчас расставлены просто по материальному балансу...
-
Спасибо! ПАВ вроде тоже найдены. Это скромный вопрос учителя в обычной школе для проекта ученика...
-
Можно ли узнать где посмотреть данные по химическому составу стиральных порошков? причем нужны формулы веществ((( спасибо
-
Можно попросить вас расчет ваш написать? хочу понять где косяк у меня....
-
По моему, выше мной вообще левый ответ дан... сейчас получается 0.44, но в ответе - 0,44
-
Я смогу только завтра написать - с собой только фото задач.... Можно узнать, как вы решали? Ну и что получилось....
-
ответ тот же по числам, но положительный... -0.25- (0.059 умн log10 (1/7 умн 10 -13))\4 = - (174+59log10(17))\4000
-
///
-
Помогите, пожалуйста, понять решение задачи 53. Получается -0,0616491. Но в ответе положительное значение....
-
Помогите понять, где ошибка? По моим расчета: n+m= (7+2+1)\2-2 = 3 m=3-3=0. Но в ответе 1

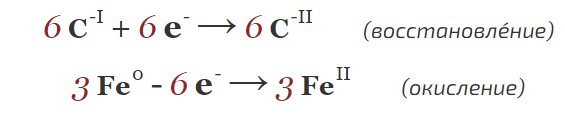
.jpg.8541c95757ef2a7f203faa04c326b54c.jpg)

