-
Постов
36 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные IZOTOP
-
-
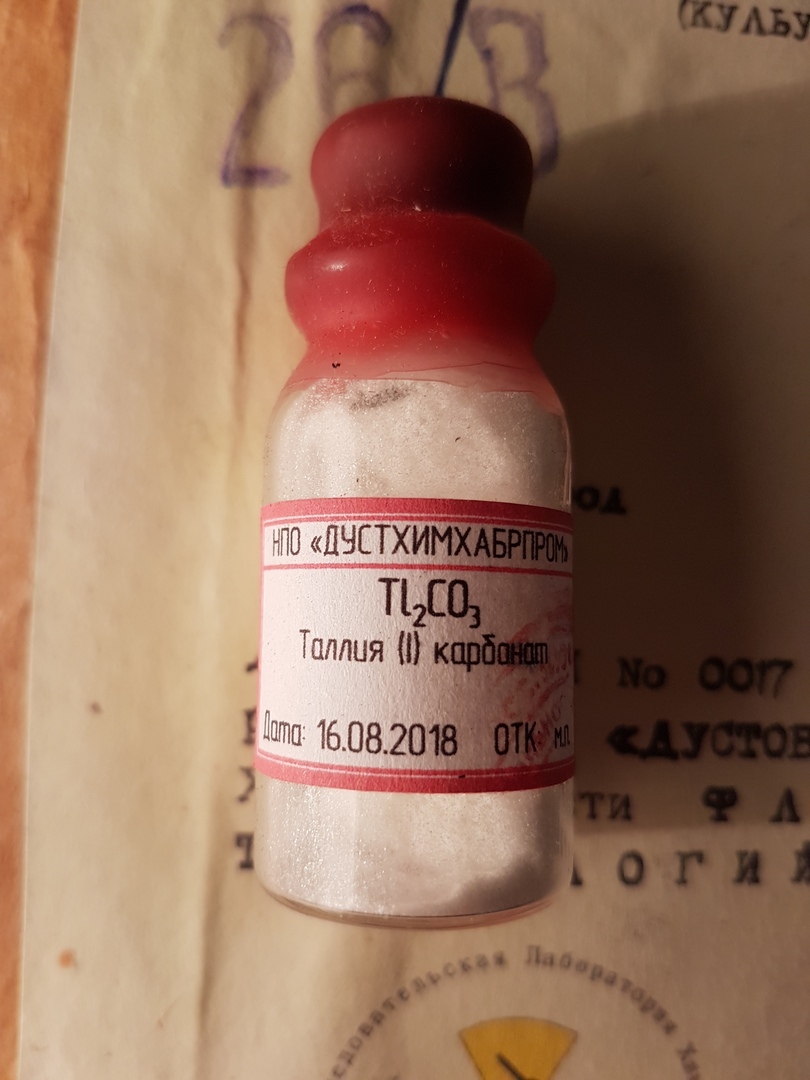
Раствор Клеричи — водный раствор, содержащий равные доли формиата таллия Tl(HCO2) и малоната таллия Tl2(OOCCH2COO). Назван по имени итальянского геолога Энрико Клеричи.

Одним из уникальных свойств этой жидкости является плотность, которая в зависимости от температуры и разбавления может варьироваться в широких пределах — от 1 до 5 г/см3. Она может быть настолько высокой, что в ней могут плавать шпинель, гранат, алмаз и корунд. В настоящее время растворы таллия не используют для определения плотности. Как и все соединения таллия, раствор высокотоксичен!

Старые растворы таллия имеют темно-коричневый цвет в следствии ОВР

При разбавлении раствора таллия водой можно заметить понижение интенсивности цвета раствора. Чистые соли ацетата и малоната таллия - это бесцветные вещества, окраска обусловлена окисленным состоянием таллия и примесями переходных металлов.

С одной стороны, таллий сходен со щелочными металлами. И в то же время он чем-то похож на серебро, а чем-то на свинец и олово. Судите сами: подобно калию и натрию, таллий обычно проявляет валентность 1+, гидроокись одновалентного таллия TlOH – сильное основание, хорошо растворимое в воде. Как и щелочные металлы, таллий способен образовывать полииодиды, полисульфиды, алкоголяты... Зато слабая растворимость в воде хлорида, бромида и иодида одновалентного таллия роднит этот элемент с серебром. А по внешнему виду, плотности, твердости, температуре плавления – по всему комплексу физических свойств – таллий больше всего напоминает свинец. И при этом он занимает место в III группе периодической системы, в одной подгруппе с галлием и индием, и свойства элементов этой подгруппы изменяются вполне закономерно. На фото представлен осадок хлорида таллия, выпавший из раствора Клеричи при добавлении в него соляной кислоты.

При добавлении раствора йодида калия к раствору одновалентного таллия выпадает желтый осадок йодида таллия (I), который может растворяться в избытке серной кислоты с образованием кислого сульфата таллия(I)

При добавлении охлажденного тиоцианата калия к холодному раствору таллия можно заметить образование кристаллов тиоцианата таллия (неорганическое соединение, соль металла таллия и роданистоводородной кислоты c формулой ТlSCN). При нормальных условиях представляет собой бесцветные тетраэдрические кристаллы, растворяются в горячей воде.

Таллий можно осадить разными анионами из раствора. В лабораториях НПО ДУСТХИМХАБРПРОМ еще с советских времен занимаются химией таллия. Для демонстрации нерастворимых соединений таллия мы провели ряд опытов с классическими анионами в химической практике. Описание веществ слева на право:
1- исходный раствор ацетата-малоната таллия
2- гексацианоферрат(III) таллия сомнительного состава Tl3-xKx[Fe(CN)6]
3- бромат таллия TlBrО3 (плохо растворим в холодной воде)
4- гидроксид таллия (III) в смеси с MnO2 после смешивания перманганата калия и гидросульфата таллия (I)
5- гексацианоферрат(II) таллия сомнительного состава Tl4-xKx[Fe(CN)6]
6- тиоцианат таллия TlSCN (окраска из-за примеси железа)
7- молибдат таллия Tl2MoO4
Подчеркивая сочетание различных свойств в этом элементе, французский химик Дюма писал: «Не будет преувеличением, если с точки зрения общепринятой классификации металлов мы скажем, что таллий объединяет в себе противоположные свойства, которые позволяют называть его парадоксальным металлом». Далее Дюма утверждает, что среди металлов противоречивый таллий занимает такое же место, какое занимает утконос среди животных. И в то же время Дюма (а он был одним из первых исследователей элемента №81) верил, что «таллию суждено сделать эпоху в истории химии». Эпохи таллий пока не сделал и не сделает, наверное. Но практическое применение он нашел (хотя и не сразу). Для некоторых отраслей промышленности и науки этот элемент по-настоящему важен.
Наиболее устойчивая положительная степень окисления таллия – +1, соединения трехвалентного таллия менее стабильны. Одновалентный таллий может быть окислен в растворе только сильными окислителями: пероксидом водорода, персульфатами, перманганатом калия, бромом или хлором (элементарные галогены окисляют таллий только до одновалентного состояния). Для таллия характерно образование соединений с формально промежуточной степенью окисления, в которых часть атомов таллия имеет степень окисления +1, а другая часть – +3. Обычно трехвалентный таллий в них входит в состав комплексного аниона, например, один из хлоридов таллия – Tl2Cl4 является тетрахлороталлатом (III) таллия (I): Tl+1[Tl+3Cl4].
p.s.: работали ли вы с соединениями таллия? с какой формой таллия вы сталкивались в своей деятельности?-
 1
1
-
 4
4
-
 1
1
-
-
Только что, Вадим Вергун сказал:
Никаких, я жить хочу.

да, дело опасное конечно. Но свои результаты это тоже приносит, метод все же хороший
-
ТАЛЛИЙ В ОРГСИНТЕЗЕ ОТ НПО ДУСТХИМХАБРПРОМ
Среди химиков сложилось мнение, что область металлоорганических соединений ртути и таллия, других тяжелых металлов занимает особое место в органической химии по отношению к области органических производных цинка, магния и щелочных металлов ввиду различия в свойствах этих двух типов металлоорганических соединений. Последний фактор объясняется в свою очередь различием свойств самих металлов, т. е. ярко выраженным металлическим характером щелочных металлов, а также цинка и магния, и появлением амфотерных свойств у тяжелых металлов. Доказательством особого места химии металлорганических соединений тяжелых металлов до сих пор служило то, что она не могла принять такого активного участия в органическом синтезе. Вместе с тем благодаря значительной прочности и устойчивости своих металлоорганических соединений она сумела выделиться в особую область, представляющую огромный интерес для развития органической химии.
Йодид одновалентного таллия является основным компонентом при синтезе триметилталлия

ОКСИД ТАЛЛИЯ (III) является основным прекурсором для получения ТТН и ТТФУ используемые при таллировании в НПО ДУСТХИМХАБРПРОМ
Особенности таллийорганических соединений
Наиболее стабильными таллийорганическими соединениями являются диалкильные и диарильные производные R2TlX. Они имеют ионное строение, причем линейные катионы R2Tl+ изоэлектронны соединениям ртути типа (II) R2Hg. Другими словами ионы R2Tl+ и молекулы R2Hg имеют одинаковое количество электронов. Поэтому химические свойства ионов R2Tl+ и молекул R2Hg очень схожи. Моноалкилталлиевые соединения неустойчивы из-за легко протекающего восстановительного элиминирования, в ходе которого трехвалентный таллий Tl (III) переходит в одновалентное состояние в Tl(I)

Полностьюмещенные таллийорганические соединения также можно получить и исключительно из RMgX - при использовании в качестве растворителя ТГФ и подборе условий реакции:


Триметилталлий получают взаимодействием одновалентного TlI, двух эквивалентов метиллития и CH3I:

При этом в начале происходит процесс окислительного присоединения (или внедрения) TlI к CH3I, а затем происходит алкилирование монометильной дийодидной соли:

Ароматическое таллирование
Арильные монозамещенные соединения таллия (ІІІ) получают путем обменных взаимодействий между тригалогенидными или трифторацетатными (и другими карбоксилатными) таллиевыми трехвалентными производными и соответствующими арилэлемент органическими соединениями

Эффективным методом является и прямое взаимодействие в трифторуксусной кислоте:

Ароматическое таллирование - это обратимый процесс с исключительно высокими пространственными требованиями. Активирующие электронодонорные заместители при кинетическом контроле реакции дают пара- и орто- изомеры, но в условиях равновесия при термодикамическом контроле в продуктах реакции преобладают мета- изомеры. Например:

Практическое использование ароматического таллирования связано с тем, что в таких соединениях таллий очень легко можно заместить на другие группы. В частности, действие I2 или KI представляет собой удобный метод синтеза совершенно чистых (не содержащих иных изомеров) иодидов:


Последняя реакция проводится in situ последовательной обработкой промежуточных бис-трифторацетатов арилталлия указанными реагентами и является методом синтеза фенолов, не имеющих в исходном субстрате активирующих групп.
P.S.: КАКИЕ МЕТОДЫ ТАЛЛИРОВАНИЯ ВЫ ИСПОЛЬЗОВАЛИ В СВОЕЙ НАУЧНОЙ ДЕЯТЕЛЬНОСТИ? -
очень здорово, хотел познакомиться с такими людьми, т.к. в нашей конторе маленький отдел только занимается изотопами
уран в свое время изводили килограммами)
щас сильно бюрократический момент вырос, в плане работы с изотопами
а по поводу лицензий, у нас на работе с этим проблем нету)Только что, IZOTOP сказал:18 часов назад, Максим0 сказал:Чтож... будем знакомы, я химфизик и с серьёзными источниками гаммы мне доводилось работать, знаю где в округе никем не охраняемые природные радиоактивные материалы - в том числе и переваливающие за 1 Р/ч по гамме. Могу наладить производство радия-226 граммами... только для запуска производства и преодоления бюрократии многие лимоны надобны (нету лишних на это дело) - и гарантированный спрос - с которым нынче просто никак. Могу также соорудить плазменный фокус на дейтерии... только как с ним бабки отбить?
Касательно же радиофобии... в пяти метрах от меня лежит источник на радии-226 показывающий 7 мр/ч если счётчиком уперется - и никаких кожухов уроме миллиметрового пластика у него нет - только квадрат расстояния. Потом имеется рентгеновская трубка запитанная 15 кВ с германиевым анодом - микросхемки просвечивать ей очень удобно. До кучи есть 0,5 кг самарскита содержащего 20 г урана (замотан в ПОС чтоб не звенел) - но перерабатывать на уран жаба душит - в цельном виде он гораздо ценнее.
Но если вам так интересно, на форуме есть товарищи с лицензиями на работу с радиоактивными материалами. Может кого-нибудь вы и заинтересуете вашим радиоталлием.
очень здорово, хотел познакомиться с такими людьми, т.к. в нашей конторе маленький отдел только занимается изотопами
уран в свое время изводили килограммами)
щас сильно бюрократический момент вырос, в плане работы с изотопами
а по поводу лицензий, у нас на работе с этим проблем нету) -
17 часов назад, Максим0 сказал:
круче лютеция, скандий будет)
а за цену это "оборот", т.к. даже некоторые псевдокомпании им не торгуют, простым смертным он недоступен
химикам, да и то не всем. хотя кому он нужен в современности
лютеций и скандий поинтереснее будет. в конторе из них поликристаллическую оптику делаемВ 12.07.2019 в 19:13, dmr сказал:Родной, задолбал со своим таллием. Ну любишь его, хоть спи с ним, хоть ешь, хоть целуйся. Но нахрен стопицот тем об одном и том же
я так то с вопросом обратился, в чем прикол люминесценции. как она там появилась?
-
я радиохимик, от радионуклидов не уйти
-
на самом деле он желтоватый, немного напоминает самарий 3+, но больше к молочному оттенку
видимо освещение вносит свой вклад
препараты весьма свеженькие, а степень "желтизны" в этих псевдокристаллах зависит от стехиометрии 1-хфоточувствительный материал
-
ДУСТХИМ рассказывает о барахле и реактивах!
Единая общепринятая классификация химических реактивов по чистоте отсутствует. Теоретически, химически чистое вещество должно состоять из частиц одного вида. Практически химически чистым считают вещество наивысшей возможной степени очистки при данном уровне развития науки и техники.

Следует сразу же отметить, что трудно определить однозначное соответствие между квалификациями химических реактивов, принятыми в РФ и в других странах, поскольку многие крупные компании, которые производят и поставляют на рынок химические реактивы, применяют собственную систему присвоения квалификаций. Такая система основана, главным образом, на том, что отличающиеся друг от друга по степени чистоты химические реактивы выпускаются под различными торговыми марками.
ККлассификация химических реактивов, принятая в РФ
Существующая в РФ классификация химических реактивов базируется на положении о присвоении реактивам квалификации, принятом в СССР:
- «Технический»(«тех.») — низшая квалификация реактива. Содержание основного компонента выше 95 %. Цвет полосы на упаковке — коричневый.


- «Чистый» («ч.») — содержание основного компонента (без примесей) 98 % и выше. Цвет полосы на упаковке — зелёный.

- «Чистый для анализа» («ч.д.а.») — содержание основного компонента может быть выше или значительно выше 98 %, в зависимости от области применения. Примеси не превышают допустимого предела, позволяющего проводить точные аналитические исследования. Цвет полосы на упаковке — синий

- «Химически чистый» («х.ч.») — высшая степень чистоты реактива. Содержание основного компонента более 99 %. Цвет полосы на упаковке — красный.

- «Особо чистый» («ос.ч.») — квалификация установлена для веществ высокой чистоты. К особо чистым относятся вещества более высокой степени чистоты по сравнению с соответствующими химическими реактивами высшей из существующих квалификаций. Особо чистые вещества содержат примеси в таком незначительном количестве, что они не влияют на основные специфические свойства веществ. Число и концентрация примесей в отдельных особо чистых веществах различны и определяются, с одной стороны, потребностями практики, а с другой — достижениями препаративной и аналитической химии. Цвет полосы на упаковке — жёлтый.


Каждому особо чистому веществу присваивается соответствующая марка в зависимости от природы и числа т. н. лимитируемых (=контролируемых) в нём примесей, а также их содержания:
- Для особо чистых веществ, в которых лимитируются только неорганические примеси, марка обозначается буквами «осч» (особо чистый) и следующими за ними двумя (через тире) числами: первое показывает количество лимитируемых неорганических примесей, второе — отрицательный показатель степени суммы содержания этих примесей (примеси, лимитируемые по той же норме в одноимённом химическом реактиве, не учитываются). Например, марка особо чистого вещества, в котором лимитируются 11 неорганических примесей и сумма их составляет 2,5×10−4% (масс.), обозначается «осч 11—4».
- Для особо чистых веществ, в которых лимитируются только органические примеси, марка обозначается буквами «оп» (органические примеси), затем (через тире) числом, соответствующем отрицательному показателю степени суммы их содержания, и буквами «осч». Так, марка особо чистого вещества при сумме содержащихся органических примесей 10−3% (масс.) обозначается «оп—3 осч».
- Для особо чистых веществ, в которых лимитируются как органические, так и неорганические примеси, при установлении марки учитывается содержание тех и других примесей. Например, марка особо чистого вещества, имеющего сумму органических примесей 2×10−4% (масс.) и сумму восьми неорганических примесей 3×10−5% (масс.), обозначается «оп—4 осч 8—5».

Особо чистые вещества получают путём т. н. глубокой (=наиболее тщательной) очистки веществ, для которой широко используют различные физико-химические методы (как правило, в сочетании)— осаждение, ректификация, дистилляция, экстракция, сорбция, ионный обмен и т. д. Разделение может быть основано и на различии в химических свойствах компонентов исследуемой системы, что позволяет использовать для получения особо чистых веществ также комплексообразование, избирательное окисление или восстановление и т. п. При очистке веществ следует учитывать возможное поступление загрязняющих примесей из воздуха, реактивов, воды, а также из материала аппаратуры.

Различные области применения химических реактивов налагают особые ограничения на содержание примесей, в связи с чем имеются специальные виды квалификаций, например:
также для:
Большинство химических реактивов контролируют по двум-трём характеристикам. Однако многие кислоты, основания и соли, а также реактивы, применяемые в биологических исследованиях, контролируют по более чем 20 показателям. При этом важно также учитывать наличие взвешенных частиц, так как даже разбавленный раствор взвешенных частиц с линейными размерами меньше 1 мкм может внести заметный вклад в суммарную концентрацию примесей.

Требования к качеству химических реактивов, выпускаемых в РФ, определяются Государственными Стандартами (ГОСТ) или Техническими Условиями (ТУ).
-
САМЫЙ ПСЕВДОСЕКРЕТНЫЙ МУЗЕЙ
Делегация НПО ДУСТХИМХАБРПРОМ направляется в ВНИИХТ

Этот музей существует уже полвека, но до сих пор о нем знали только специалисты. В помещении музея нельзя находиться более 4 часов. На входе сюда вам предложат надеть халат, а на выходе — настоятельно посоветуют вымыть руки, даже если вы не касались экспонатов. Сюда не пускают детей и школьников, это, пожалуй, единственный в мире геологический музей 18+. Знакомьтесь — музей урановых руд ВНИИХТа.

Как и все, что касается советского атомного проекта, до недавнего времени музей был скрыт от посторонних глаз грифом «Совершенно секретно». География музея впечатляет — 8446 образцов из 47 стран мира. Здесь представлены 752 месторождения и рудопроявления, причем о некоторых теперь могут рассказать только музейные экспонаты, поскольку сами месторождения уже отработаны, закрыты и рекультивированы — на их месте сейчас лесопарки. Как правило, это старые немецкие и чешские копи, где уран добывали еще в начале XX столетия, и даже раньше, когда люди еще ничего не знали о радиоактивности, а вторичные минералы урана использовались для изготовления красок…

Витрина с вторичными минералами урана — одна из самых ярких в экспозиции. Если уранинит, каффинит и настуран — первичные урановые минералы — не блещут особой красотой, их цвет колеблется от серого до черного, то вторичные минералы, образовавшиеся в сухих и жарких условиях, являют настоящее буйство красок. Желтый, зеленый, салатовый, даже оранжевый (в оранжевый цвет, правда, больше окрашены минералы содержащие торий).

Вторичные минералы урана хорошо растворимы в воде, поэтому с древнейших времен используются для изготовления красителей для керамики. Археологические находки свидетельствуют, что оксид урана применялся при изготовлении желтой глазури для керамической посуды еще в I веке до нашей эры. Черепки с остатками глазури, содержащей более 1% урана, находили на развалинах Помпеи и Геркуланума.
Впрочем, «урановые» красители — не средиземноморское ноу-хау. Использовали оксид урана как краситель и кочевники Средней Азии, что помогло открыть одно из месторождений урана в Кызылкумах. Рассказывает Галина Демкина, старший научный сотрудник ВНИИХТ:

«Вопрос обеспечения атомной отрасли ураном в конце 40-х начале 50-х годов стоял очень остро. И хотя атомная бомба была создана в СССР к концу 1948 года, для ее создания использовался контрибуционный уран, поставлявшийся из Германии и Чехословакии. Собственный уран в промышленных количествах появился у советских атомщиков лишь к началу 50-х годов… Когда искали урановые залежи — а их искали по всей стране — летчики буквально «облизывали» все перспективные горы и долины на малых высотах, делая аэросъемку специальной аппаратурой, реагирующей на гамма-излучение. И вот, после одного из таких вылетов был обнаружен участок с повышенной радиоактивностью, куда на рекогносцировку был отправлен геолог-уранщик. Прибыв в район, он начал поиск и через какое-то время наткнулся на юрту. По восточному обычаю, хозяин пригласил его, угостил чаем… И вот, сидя в юрте и прихлебывая чай, геолог вдруг заметил на жердях, из которых состоял каркас юрты, орнамент характерного ярко-зеленого цвета. Геолог понял, что краска сделана на основе вторичных минералов урана, и спросил хозяина, откуда он берет краску. Тот подробно рассказал, как найти место с зелеными камнями...»

Есть здесь экспонаты и с уникального в своем роде месторождения Меловое, что в Казахстане. Там уран образовался в осадочных породах, состоящих в основном, из скелетов древних рыб. «Ураноносные зубы акул» — звучит как фантасмагория, тем не менее, такие образцы в коллекции музея тоже есть.

Большая часть экспонатов — 6200 из 8446 — содержат уран и другие радиоактивные минералы. Европа, Азия, обе Америки, Африка…Есть даже образец радиоактивной породы из Антарктиды — ториевый пегматит. Только из Австралии советским геологам не удалось получить ни одного образца. «Это задача на будущее» — шутят смотрители музея.

Музей лишь немногим моложе ВНИИХТа — одного из ведущих атомных институтов в СССР. Сам ВНИИХТ был создан в 1951-м, а уже в 1953 году министр среднего машиностроения Вячеслав Малышев подписывает приказ о создании специализированного музея урановых руд. Более полувека на образцы урановых пород сюда приходили смотреть лишь специалисты, имеющие допуск к работе с секретными материалами. Кстати, музей — не собрание мертвых образцов, здесь ведется научная работа.

Сюда приходят студенты писать дипломы и курсовые работы, здесь хранится база данных по всем месторождениям урана и редкоземельных элементов, некоторые из них были открыты в 50-60 годы и «хорошо забыты». Например, недавно, когда в России начал активно развиваться бериллиевый проект, бизнесмены и ученые запросили из музея всю информацию по бериллиевым месторождениям, даже образцы с этих месторождений были заново оценены на содержание бериллия. Как нам стало известно, сейчас сотрудники ВНИИХТ и «Росатома» работают над тем, чтобы уникальная коллекция руд и минералов была открыта для широкого доступа.

-
 2
2
-
 1
1
-
-
я работал с эвтектиками хлорида таллия 1. очень летучий этот хлорид падла, а уж фторид еще сильнее. После синтеза установку пришлось утилизировать как СДЯВ. никому не пожелаю столкнуться с хлоридом или фторидом таллия. аэрозоли падлючие с них выходят. в вакууме летят сильно, сорбируются на всех поверхностях, особенно на графите и графитовом волокне. Очистить никак нельзя. фотокарточку всяких соединения таллия прикрепляю для атмосферы. я на на таллии собаку съел


-
Всем привет! Многие химики знают, что таллий — один из самых опасных материалов в химической технологии. А некоторые его соединения обладают коллоидальной токсичностью, например ацетат или формиат таллия. Все соединения таллий являются тиольными ядами. Если соединение таллия органическое — то оно обладает еще более сильно выраженным токсикологическим свойством.
Почему коллекция соединений таллия может быть интересной? Кхе… а вы хоть раз их видили, даже хотя бы в интернете?) ПОЕХАЛИ!

Металлический таллий. По правилам его хранят в сухом глицерине или полиэтиленгликолях. В алканах он имеет небольшую растворимость, в следствии чего можно отравиться парами растворителя.





Обратите внимания, что данный кусочек таллия очень сильно окислен. Вся его поверхность покрыта слоем оксида


Вот мы добрались и до его солей. Все они ядовиты.


Таллий все же нашел свою нишу в химической технологии. В настоящее время таллий так же используется кое-где в промышленности, в силу того, что его просто нечем заменить.
- Таллий вводится в качестве активатора в кристаллы иодида натрия, использующегося в качестве сцинтиллятора для регистрации ионизирующих излучений.
- В инфракрасной оптике в качестве материалов линз применяются бромиди иодид таллия(I). Кроме того, в годы Великой Отечественной войны оксисульфид таллия (таллофид) применялся в качестве чувствительного элемента приборов ночного видения[9].
- Иодид таллия(I) добавляют в осветительные металлогалогеновые лампы.
- Раствор Клеричи, состоящий из формиата таллия (HCOOTl) и малонататаллия (CH2(COOTl)2), используется в минералогии для определения свойств минералов.
- Сульфат таллия(I) и карбонат таллия(I) ранее применялись в качестве средства для борьбы с грызунами в труднодоступных местах.
- Трёхвалентный таллий является основным компонентом некоторых относительно сильных окислительных реагентов в органическом синтезе




А этот оранжевый порошок настоящий ЖИР! Это диуранат таллия (I). Таллий и радиация в одном флаконе.









Соединения таллия относят к категории кумулятивных ядов — накапливающиеся патологические симптомы при хроническом отравлении. Соединения таллия поражают периферическую нервную систему, желудочно-кишечный тракт и почки.
Ионы одновалентного таллия Tl+ замещают ионы калия в биохимических процессах из-за сходства их химических свойств. Таллий концентрируется в волосах, костях, почках и мышцах.
Характерный симптом отравления соединениями таллия — частичное выпадение волос, при значительной дозе — тотальная алопеция. При высокой дозе — алопеция нехарактерна, так как человек погибает от отравления до наступления потери волос. Смертельная для взрослого человека доза таллия в соединениях составляет 600 мг.

НО ХИМИКАМ С НПО ДУСТХИМХАБРПРОМ ТАЛЛИЯ ВСЕГДА МАЛО! Что может быть прекрасней радиоактивных изотопов таллия?

-
 1
1
-
-
Слепые химики - или как ДУСТХИМИКИ по секретным комнаткам эпихлоргидрина ходили
По мотивам слепонезрячих секретных псевдохимиков с провинциального ХИМПРОМА. Сегодня НПО ДУСТХИМХАБРПРОМ расскажет историю, которая развернулась между двумя близко знакомыми химиками...
Промозглая осень. Дождливо, холодно, мокро.
Личность в бежевом плаще и старомодной шляпе элегантно ливитировала меж луж. С массивным кожанным и опечатанным портфелем в руках. Личность спешила.
Федор Викторович, был приветливым и дружелюбным человеком, внутренне красивым, а открытость и улыбка доставляли радость окружающим. Воспитанный, тактичный, скромный и спокойный, «это тот, которого мало» . Сам о себе он никогда так не скажет, он – интеллигент. Ни разу я не замечал, что бы он позволил бы себе относиться к людям с пренебрежением и демонстрировать свое превосходство.
Как-то в гости к нему пришёл его давний коллега Дмитрий Чернаков. Который как и Фёдор Викторович работал на заводе ЭПХГ, и был ведущим химиком производственного объединения "Химпром"хлорпроизводное окиси пропилена, с формулой СH2(O)CH-CH2Cl.
Фёдор Викторович как обычно сказал своему гостю:
"Проходи, проходи. Давай наливай чай, а я пока у себя в лаборатории кое-что закончу"
Знал-бы Викторович, что выйдет боком, ему эта фраза.
Через 5 минут ведущий химик ПО Химпром стоял в лаборатории с нарезной колбаской, двумя рюмками и бутылкой ХЧшного ГОСТовского этанола.
Они вместе распили бутылку, а пока выпивали дискутировали на тему закрытия их предприятия. Ведь именно Викторович настоял на том. Что-бы всё-таки перестроить "Химпром" и заключить партнерский договор с компанией РОСНАНО.
Дмитрий-же очень сожалел о крахе своего предприятия и часто ругался с Федором на эту тему.
"Когда Дима ушёл я ослеп."
Дмитрий заменил содержимое бутылки с этанолом, на метанол. И я уверен, что метанол из нашей-же с ним лаборатории.
Мне очень часто снится один и тот-же сон. О месте своей работы. Я помню до мельчайших подробностей устройство всего комплекса эпихлоргидрин.
Шестиэтажный цех производивший хлорпроизводное окиси пропилена, с формулой СH2(O)CH-CH2Cl. Комплекс был по истине масштабен.
Любой работник ПО восхищался размерами и сложностью устройства ЭПХГ.
Вот тут у нас пультовая. Представляешь! Один пульт управляет всем этим предприятием!
Тут трудились десятки сотрудников, в три смены они следили за исправностью работы комплекса.
Сейчас всё вокруг покрывает 0,3мм слой ядовитой пыли содержащей в своем составе аллилхлорид — хлорорганическое соединение c эмпирической формулой C3H5Cl, систематическое название 3-хлорпропен.
Десятками по всей площадке разбросаны современные на тот момент противогазы ПММ-88...
Профсоюзная жизнь предприятия была крайне насыщенной, регулярно в ДК ЭПХГ проводились мероприятия по профилактике терроризма и разнообразные лекционные заседания.
На этаж ниже, под пультовой был технический этаж. Работали тут электрики. Среди них был замечательный человек Андрей Маликов, специалист с большой буквы, он за день мог собрать ВРУ целого цеха!
В бытовке "Андрюхи" стоял сверлильный станок. Не совсем понимаю, зачем электромонтеру сверлильный станок, я еще понимаю он у меня просил приборы старые ему отдавать, кстати они на фото ниже, а вот они лежат под слоем ядовитой пыли хлористого алила.п/я 1523)
А вот и его станок сверлильный...
Ещё в бытовке был шкаф. В котором "Андрюха" хранил документы, мы очень часто с ним ругались, относительно неправильного хранения секретки. После года подобных споров, я подарил ему такой же стеллаж, только с закрывающимися и пломбируемыми дверками.
У него на столе стоял будильник, без стрелок. Но каждый день, во время окончания смены он звонил. Как говорил Андрей, стрелки он снял для того, что-бы время летело быстрее. Каждый день на заводе как предыдущий
А на подоконнике он хранил лекарства. Он с детства чем-то болел. Но мне он до сих пор так и не рассказал чем.
Рядом с ЭПХГ находился штаб газозащиты. Что-бы туда попасть нужно было пройти через испытательный стенд, для тестирования разработок в области СИЗОД, через массивную герметическую дверь.
Внутри мои коллеги разрабатывали противогазы и защитные костюмы, в том числе с защитой не только от химических патогенов, но и от биологических. Некоторые образцы прототипных разработок по сей день находятся под толщей бетона зараженного ртутью.
Больше я практически ничего не помню из производственных помещений, но в следующий раз, я расскажу вам про Центральную Лабораторию Завода, состоящую из 5 этажей лабораторий разного назначения, втч и оборонного назначения.
С уважением, от химиков (п/я 1523) п/о ДУСТХИМХАБРПРОМ от 02.02.2015
-
 1
1
-
-
Всем привет! Хочу показать вам пару снимков заброшенной лаборатории, которые были в секретном делопроизводстве нашего предприятия.
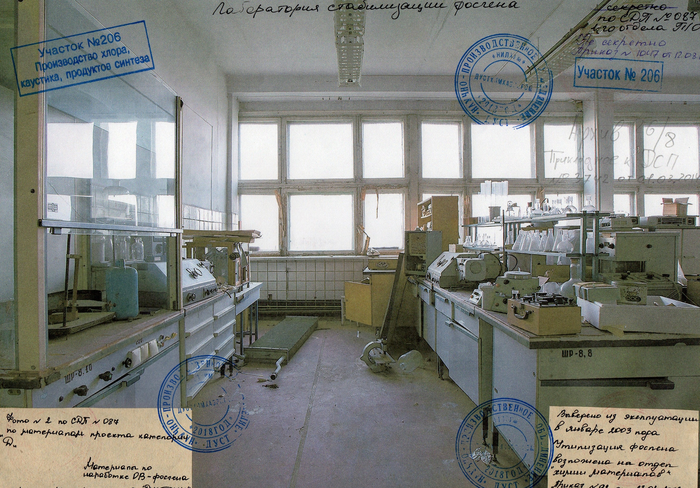
На кадрах представлена лаборатория, в которой в советское время наше предприятие производило и изучало фосген (химическое оружие, а так же важное сырье в органическом синтезе), ну а в подвалах кое-чем поинтереснее занималось.
В секретной папке в основном содержались методики синтеза и испытания фосгена и его производных. Нам же достались лишь старейшее наследие прекурсоров к грифовым методам синтеза.
Данный производственный корпус в настоящее время реставрируется
Планируется открыть целый аналитический центр при нашем НПО
Приятного просмотра для ценителей )
-
"ДИЛЕММА ДНЯ! ПОЧЕМУ ТАЛЛИЙ + И САМАРИЙ 3+ В ЙОДИДЕ АММОНИЯ ОБРАЗУЮТ СВЕТОСОСТАВ С ЛЮМИНЕСЦЕНЦИЕЙ, А НЕ ФЛЮОРЕСЦЕНЦИЕЙ?"
Сегодня я хочу рассказать о новых рецептах светящихся порошков. А так же затронуть природу флуоресценции такого редкого и опасного материала как таллий. Все эти порошки, которые вы видите на кадрах светятся в ультрафиолетовых лучах благодаря ионам одновалентного таллия, всего лишь один химический элемент дает такой большой спектр окраски! Таллием остается только восхищаться
А пока давайте разбираться почему это все светится и причем здесь вообще таллий. Название элемент таллий получил по характерным зелёным линиям своего спектра и зелёной окраске пламени. Название элемента произошло от греческого слова таллос — что значит молодая, зелёная ветвь.
По сути мы будем использовать различные доступные вещества такие как йодид аммония, йодид калия, бромид калия, карбонат аммония и допировать их разной концентрацией ионов одновалентного таллия. Свечение полученных кристаллов будет зависеть от концентрации таллия в веществе.
В связи с крайней ядовитостью таллия достать его не реально, наверное даже радий проще найти и достать чем таллий, так же таллий находится в втором списке СДЯВ, и приобретение и работа с солями таллия карается законом российской федерации. Но в нашем институте разрешено работать, поэтому следите за деятельностью ДУСТХИМА и обязательно расскажи о нашем проекте своим друзьям. Вернемся к таллию, в качестве активатора мы выбрали максимально ядовитое вещество – ацетат таллия, чрезвычайно токсичная соль уксусной кислоты отличной подойдет для допинга.
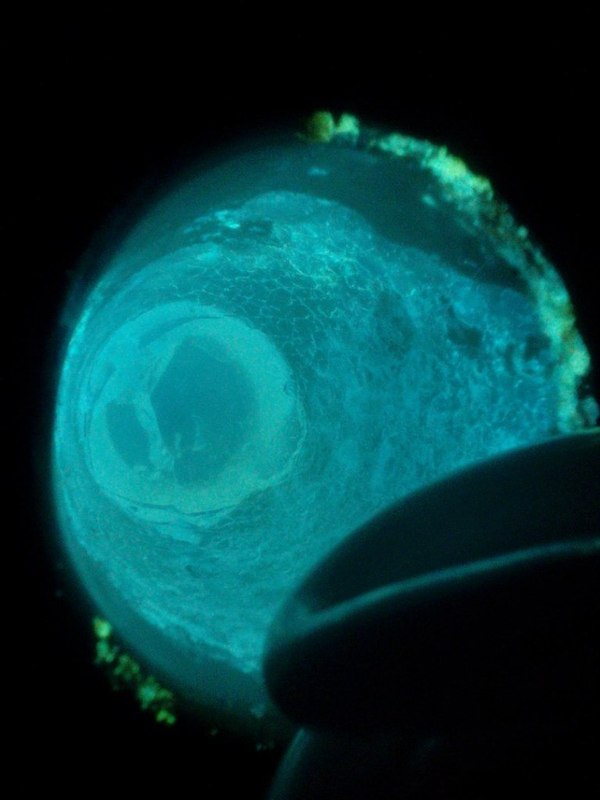
И так, в первом опыте мы используем кристаллы йодида аммония, так как именно в нем таллий имеет максимальную флуоресценцию желтого цвета. Было получено три образца с разной концентрацией таллия, но тут произошло кое что интересное, в один из образцов с максимальной концентрацией таллия я добавил хлорид самария, хорошенько выпарил раствор ии флюорофор превратился в люминофор, не могу понять почему возникает свечение в отсутствии ультрафиолета? Если среди зрителей есть знатоки в кристаллохимии то обязательно напишите в комментариях почему возникает это явление?
Образец, который имеет люминесценцию, помимо таллия содержит и хлорид самария (III)
Немного по поводу получения таких порошочков. Все очень просто. Сначала готовится концентрированный раствор носителя, например йодида калия, в этот раствор вводятся ионы таллия в малых концентрациях, то есть в одну сотую или одну тысячную таллия в пересчете на концентрацию носителя. Затем раствор аккуратно выпаривается, полученные кристаллы измельчаются диспергированием в этаноле, а потом сушатся в эксикаторе над олеумом или концентрированной серной кислотой. После этих процедур полученный порошок начинает флуоресцировать в ультрафиолете. Физика этих процессов простая. Этот процесс активно наблюдается у силикатов магния, кальция, бериллия, бария, фосфатов кальция и стронция и особенно у галогенидов щелочных металлов, активированных небольшим количеством солей таллия. Свечение в этих случаях объясняется вхождением таллия в кристаллическую решетку галогенидов с образованием смешанных кристаллов и возможно комплексных ионов, так называемых галогенидталлатов – это производные таллиевой кислоты. Даже в десятитысячном молярном растворе таллий будет светиться в ультрафиолете.
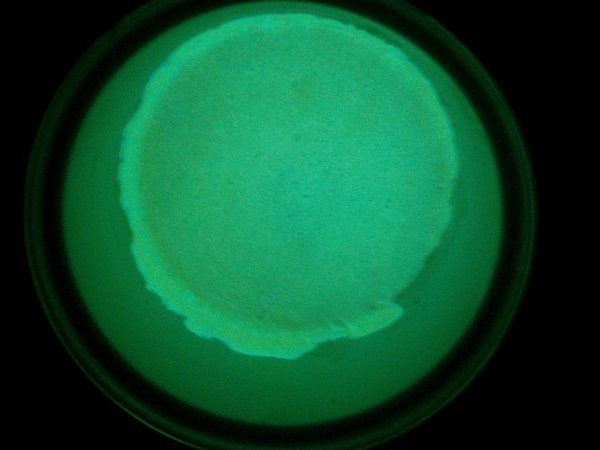
Так, теперь переходим к следующим образцам. На кадрах так же кристаллы йодида аммония и ацетата таллия, только концентрация таллия уменьшена в 200 раз, по отношению к первым образцам, как мы видим желтый цвет превратился в синий. Удивительная природа таллия и его соединений, просто потрясающе. Люминесценцией эти соединения не обладают, они лишь светятся под воздействием ультрафиолета.
Таким образом допировать таллием можно множество соединений получая разные смешанные кристаллы. А как показал опыт с солью трехвалетнотного самария еще и возможность получать таллиевые люминофоры с редкоземельными элементами. Вот так опасный яд и токсин превращается в грациозную красоту в руках химика. Была предпринята попытка допировать карбонат аммония солями таллия и самария, но люминесценции в веществе не наблюдалось, флуоресценция в образце неоднородная, но само вещество выглядит на изломе очень красиво в лучах ультрафиолета. Некоторые знатоки кристаллохимии скажут, что некоторые галогениды светятся в ультрафиолете и без солей таллия. Да это так, но таллий увеличивает интенсивность свечения этих кристаллов в тысячи и десятки тысяч раз! Это явление активно применяется криминалистами и химиками аналитиками в исследовании таллия.
Конечно это чисто показательные эксперименты, которые больше рассказывают о аналитической химии таллия, а не о люминофорах и ультрафиолетовых исследованиях, использовать такие флюорофоры для приготовления красок явно не следует даже с учетом того что таллий находится в них в ничтожно малых концентрациях. Да и соли таллия стоят целое состояние, намного дороже чем солю лютеция, самария и диспрозия с тулием. Сами по себе полученные материалы не отвечают нужным требованиям по инертности, нерастворимости в воде и стойкости к ультрафиолетовому излучению.
-
Здарова народ! Нет нет, сегодня мы не будем добавлять уран в борную кислоту как в прошлый раз, сегодня хочу рассказать вам о своем старинном опыте получения всяких люминофоров на основе борной кислоты.
И вот например простые кристаллы из борной кислоты и салициловой кислоты!


Теперь о некоторых тонкостях, которые нужно знать, чтобы приготовить такие вот кристаллы:


Борные люминофоры состоят собственно из борной кислоты, которая выступает как основа с добавлением различных органических соединений, выступающие как активаторы промежуточных соединений, образующихся при частичном обезвоживании борной кислоты. Эти люминофоры могут быть приготовлены как при сплавлении до 200°С, так и интенсивным высушиванием смеси под вакуумом при 100°С
Эти пункты очень важны для выяснения общих свойств борных люминофоров и представляют следующий перечень:
• Свечение активированной борной кислоты под ультрафиолетовым излучением происходит из-за присутствия следов органического материала.
• Люминофор мог быть приготовлен с использованием самой борной кислоты, частично обезвоженной борной кислоты, так же, используя полностью обезвоженную её форму в качестве борного ангидрида - B2O3.
• Самые лучшие и успешные результаты получены с использованием частично обезвоженными борными промежуточными соединениями, которые возникают при обезвоживании борной кислоты.
• Люминофор быстро теряет свою способность к люминесценции, как при воздействии влаги находящейся в воздухе, так и при сильном обезвоживании - люминесценция у борного ангидрида намного более слабая, чем у частично обезвоженных продуктов борной кислоты.



Полосы фосфоресценции при борной кислоте представляют собой полосы разделённые и имеющие много максимумов, но более размытые, чем, например, в затвердевшем жидком воздухе или этиловом спирте, где линейчатость спектра выступает резко. При этом, чем резче полоса и ближе по своему строению к линейчатому спектру, тем меньше влияние температуры, но как правило, борные люминофоры имеют весьма низкий температурный предел верхнего уничтожения флюоресценции и при повышенных температурах и изменение температуры в пределах нормальных условий не влияет на послесвечение. Обычно уже при +160°С все борные люминофоры не светят. Исключением являются лишь люминофоры с флуоресцеином и нафталевым ангидридом.

-
В 20.02.2019 в 10:55, vpprivet26 сказал:
Продам
Оксид тербия 99,5% - 80 р за грамм
Оксид европия 99,9% - 75 р за грамм
Оксид иттербий 99,9 - 50 р за грамм
Оксид тулия 99,8% - 80 р за грамм
Оксид скандия - 120 р за грамм
Перренат аммония (Ч) - 150 р за грамм
Гафний( порошок) - 30 р за грамм
Индий Ин-00 бруски -30 р за грамм
Галлий металл - 40 р за грамм
Москва
сколько по массе оксида скандия и какой марки?
-
в нормальные лабы конечно паленый старый оксид брать никто не будет. а простым смертным он не нужен. сам работаю с скандием. наш коллектив умеет получать 5-6 девяток после запятой для соединений скандия
сколько у вас по массе егоВ 18.02.2019 в 13:59, vpprivet26 сказал:Добрый день
Имеется оксид скандия ТУ ВЗ -649-88 марка Е , не могу найти спецификацию на этот продукт. Какая чистота у него.
сколько в наличии?
-
Доброго времени товарищи. Гулял я как-то по отравленным землям ДХХП, встретил на них очень старого химика, который Несмеянову руку жал. Пообщались за уран и плутоний, за будущее отечественной радиохимии. Оба поняли что все сгнили, поэтому он предложил пропить заначку с советских времен. А именно хлористый палладий. Думаю чуваки гальваники заценят. Сам я химией ДГМ давненько не занимаюсь. Хотя в свое время молодое изводил палладий сотнями граммов. А просто барыгам в утиль сдавать не вариант на мой взгляд такую соль
может понадобится кому-то в экспериментах, как никак ампула с самого комбината Войкова.В каждой ампуле по 10 граммов безводной соли. Ампулы ни разу не вскрывались, полностью нулевые будто с завода только вышли.
кончено в приоритете обмен на что то равноценное и интересное, но можно и на денежные эквиваленты
Отечественной науке, особенно катализу и оптике еще пригодится палладий -
имеются соединения серебра. Банки "целки" - очень хорошее хранение. Ни разу не открывались с момента запаковки на заводе
нитрат серебра - 2500р
сульфат серебра - 3000р
в наличии есть и другие ДГМ
Цена такая за сохранность компонентов и их нулевостьвот еще сульфатик серебра
100 граммов - 3000 руб. сохранность максимальная-
 1
1
-
-
15 минут назад, aversun сказал:
Какие исходники?
но в ДХХП немного другая специфика. обычно мы подводим работы к получению препаратов +2 и +3
самое веселое, после крупных синтезов на несколько килограммов, выходить проверять сточные воды нашего П/Я. И смотреть, чтобы ничего лишнего не утекло каким-нибудь загадочным способом
-
ИЗОТОПЫ - СВЕТ БУДУЩЕГО!
Хочу продемонстрировать пару фоток с свеженькими соединениями урана. Время развивать радиохимию на форуме химиков. Тут есть люди с тех САМЫХ НИИ или спецрадиохимфака?
дххп 5 - свеженький кристаллогидрат нитрата уранила, только что сваренный. фона по дочкам нет -


























































































































Люминофоры на основе SrAl2O4:Eu2+/Dy3+/Sm2+/Tm2+ от НПО ДУСТХИМХАБРПРОМ
в Неорганическая химия
Опубликовано
Продукция ОСОБОГО ОТДЕЛА 8-го СПЕЦПРОИЗВОДСТВА НПО "ДУСТХИМПРОМ". Повсеместное применение люминофоров особого назначения начато в народном хозяйстве. В соответствии с требованиями ГЛАВДУСТПРОЕКТА на базе организаций ГИПРОДУСТ-СИНТОН, НИИФЛИ, 16-го ГУ ДУСТГИПРОРЕДМЕТ были выполнены проектные работы по созданию технологической схемы и расчетов производства люминофоров. Исполнителями технологии с опытными производственными мощностями были назначены 8-е СПЕЦПРОИЗВОДСТВО НПО ДХП (предприятие А - производство спецпродукции) и ОСП-269 НПО ДХП "ТОНОТОЛ" (предприятие Б - производство прекурсоров). Аттестация и отпуск продукции поручался ведомственным отделам ГЛАВДУСТРЕАКТИВ.
Методом золь-гель технологии из бутоксидов, изопропоксидов и гидроксинитратов алюминия была получена матрица алюмината стронция с добавкой РЗЭ. Восстановление ионов РЗЭ проводилось в токе аммиака при 700 градусах Цельсия.
1. Европий(II)-неодимовый(III) алюминатный люминофор. Фиолетовый слева - глубоко восстановленная фракция и бирюзовый справа - недовосстановленная фракция в токе аммиака
2. Европий(II)-цериевый(III) алюминатный люминофор отожженный в аммиаке с длительной выдержкой
3. SrAl2O4:Eu2+/Dy3+/Sm2+/Tm2+ с короткой выдержкой восстановления
4. SrAl2O4:Eu2+/Dy3+/Sm2+/Tm2+ с длительной выдержкой восстановления
1. Европий(II)-тулиевый(III) люминофор восстановленный с ультракороткой выдержкой в токе аммиака
Дело в том, что со времени разработанного в 1996 году LLP SrAl2O4:Eu²+,Dy³+ за последние несколько лет появилось очень много патентов, описывающих синтез подобных алюминатных структур различного состава. Все приготовленные алюминаты по этим разработанным технологиям пригодны к использованию в различных целях световой маркировки. Длительность послесвечения таких люминофоров в целом ряде случаев оказывается вполне достаточной для практического их применения в качестве источников аварийного автономного освещения, для обозначения эвакуационных выходов при экстремальных ситуациях, ограждений, для подсветки различных указателей, в том числе рекламных и дорожных, шкал приборов, часов, для обозначения элементов дорожных и напольных покрытий и т.д. Но обладают разными характеристиками, как в цветовом решении, так и по скорости затухания начальной светимости и длительности дальнейшей фосфоресценции. И каждая марка может применяться согласно имеющимся индивидуальным свойствам.
Алюминатные люминофоры с РЗЭ активаторами класса материалов SRALO, SETDAO, SAORE, в последние 10—15 лет получили широкое и вполне заслуженное распространение. Связано это с тем, что они обладают высокой степенью аккумуляции энергии и высокой яркостью остаточного послесвечения в темноте. Алюминат стронция (SrAl2O4) — неорганическое соединение (твердый раствор оксидов стронция и алюминия). Широко используется в качестве основы (матрицы) для люминофоров. Наиболее распространенный представитель - соединение SrO•Al2O3 (SrAl2O4). Будучи активированным редкоземельными ионами двухвалентного европия (Eu2+) и трехвалентного диспрозия (Dy3+), представляет собой известный люминофор с длительным зеленым послесвечением.
Время и интенсивность послесвечения имеют слабую зависимость от коэффициента поглощения возбуждающего света. Более длинноволновое возбуждение соответствует, как правило, меньшей поглощательной способности люминофора, что приводит к меньшей удельной яркости свечения, но позволяет задействовать большее количество ловушек в объеме люминофора, поэтому рассеянный свет дневного небосклона является благоприятным для эксплуатации предлагаемых составов. Данный состав обладает свойствами ограничивать свою световую сумму при охлаждении. Чем сильнее охлаждение, тем дольше сохраняется энергия возбуждения. И высвобождает её по мере нагрева состава. При быстром нагреве из охлаждённого состояния световая сумма может быть очень большой. Этим свойством обладают ряд щелочноземельных, сульфидных и окисных люминофоров.
Несмотря на то что к числу редкоземельных элементов относится небольшое количество близких по своим химическим свойствам элементов периодической таблицы, тем не менее сегодня трудно назвать область военной или гражданской отрасли промышленности, использование в которой РЗЭ не давало бы эффективных результатов. При этом для достижения современного уровня решаемых задач, как правило, требуется наличие развитого наукоемкого производства и технологий. Таким образом, доля использования РЗЭ в различных сферах современной промышленности косвенно характеризует уровень развития государства в целом.