
DARIY
-
Постов
21 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные DARIY
-
-
В какой стране находится Шуртепинское месторождение?
Ни в каких источниках нет точной информации про данное месторождение. Известно, что Шуртепинское месторождение находится в Средней Азии (либо Узбекистан, либо Киргизия)
-
Что больше влияет на процесс адсорбции: величина предельной адсорбции или константа адсорбционного равновесия?
Что такое величина предельной адсорбции и константа адсорбционного равновесия?
Может ли быть так, что предельная адсорбция имеет большое значение, а константа равновесия, напротив, имеет низкое значение?
-
Даны две параллельные реакции:
С2H5OH → С2Н4 + Н2О (этилен)
2С2Н5ОН → СН3-О-СН3 + Н2О (диметиловй эфир)
Зная количество этилового спирта 150г, выходы этилена (69%) и диметилового эфира (14%), найти массу этилена, диметилового эфира, и массу этилового спирта, пошедшего на каждую реакцию
Заранее спасибо
-
-
Синтез дифениламина (ДФА) из фенола и анилина (1/3) на NiSnMg катализаторе описывается уравнением: a – ln(1-Y) = kн/F, где Y – выход ДФА и F – скорость подачи реакционной смеси в моль/(л(катализатора) · ч). При 300⁰ С: a = 0,46 и kн = 114 моль/(л · ч). Найти выход ДФА для F = 50 моль/(л · ч) и производительность по ДФА (в расчете на фенол) для загрузки катализатора 1 м3.
Решение:
Выход ДФА находится по уравнению (преобразовываем и далее выражаем Y)
Y = 0,84
Необходимо найти производительность по ДФА ( Производительность-это кол-во продукта полученного в единицу времени)
F - скорость подачи реакционной массы 50 моль/(л · ч)
Y- Выход ДФА 0,84
доля фенола в смеси (1-1/3 = 2/3)
M - молярная масса дифениламина 169
И далее нужно просто перемножить эти значения? И нужно ли перевести литры в метры кубические, так как сказано, что загружается 1 м3?
Заранее спасибо)
-
Могут ли быть реакторы вытеснения периодического действия?
-
-
Задача:
Из одноканального реактора окислительного пиролиза метана получают 6000 кг/ч ацетилена. В реактор подается природный газ, в котором объемная доля метана равна 92,3 %, а кислород подается в объемном соотношении к метану 0,6:1. Коэффициент увеличения объема газов 7,5 ; время пребывания газов в реакционной камере 0,004 с. Определить высоту реакционной зоны (м) с размерами прямоугольного сечения 160 и 850 мм, если конверсия метана в данном процессе 56,1 %.
Решение:
2СH4 → C2H2 + 3H2
Найдем расход метана с учетом конверсии:
(2*22,4*6000)/(26*0,561)=18429 м3/ч - для метана
Найдем расход природного газа, где в котором объемная доля метана равна 92,3 %
18429/0,923=19966 м3/ч - для природного газа
Найдем расход кислорода (0,6:1 кислород/метан):
18429*0,6=11057 м3/ч - для кислорода
Суммарный расход газов:
11067+19966=31023 м3/ч или 8,6175 м3/с
С учетом увеличения объемов газов:
8,6175*7,5= 64,6 м3/с
Объем:
64,6 м3/с * 0,004с = 0,2585 м3
V=S*h
h= V/S=0,2585 (м3)/ (160/10000 * 850/10000) = 190 м
немного смущает ответ
-
Необходимо окислить 1,5-дифенилпентанон-2 хромовой смесью при температуре
Какие продукты реакции могут получиться:
1) фенилуксусная кислота и 3-фенилпропановая кислота
2) или образуется просто бензойная кислота и СO2
Заранее спасибо
-
-
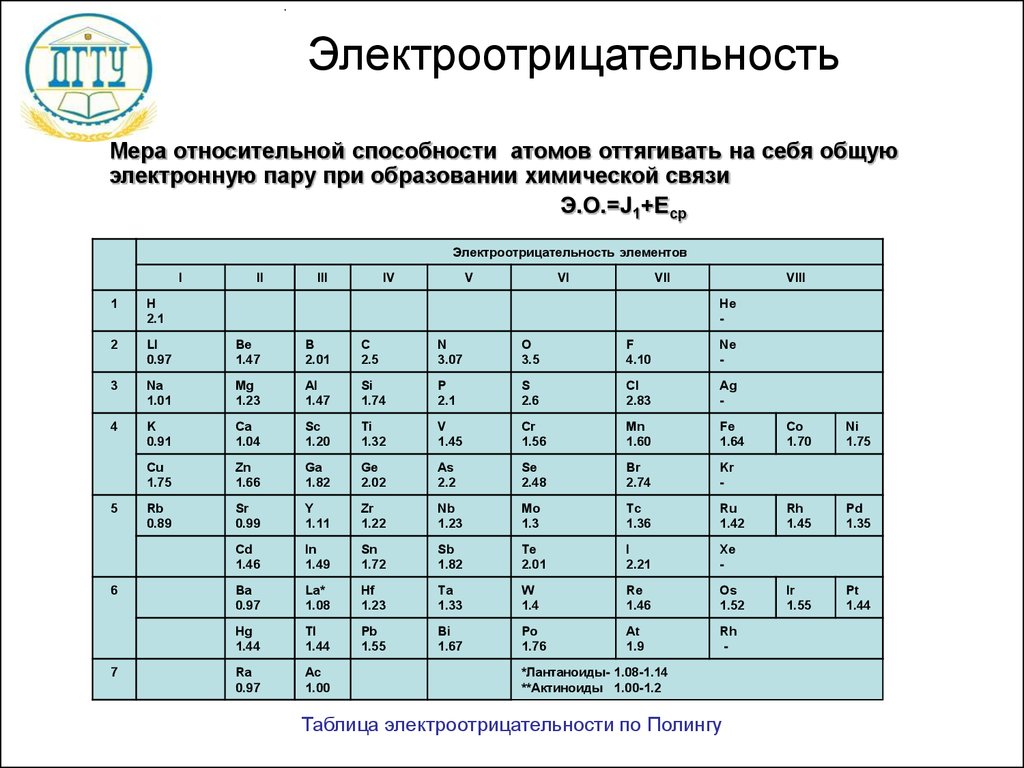
В группе сверху вниз электроотрицательность уменьшается, но у фосфора электроотрицательность больше, чем у фосфора (2,2 у мышьяка и 2,1 у фосфора).
Заранее спасибо.
-
-
Доказать, что данная реакция не пойдет, используя стандартные окислительно-восстановительные потенциалы
FeSO4 + I2 =
E(I2 / 2I-)=+0,54B (окислитель)
E(Fe+2/Fe+3)=-0,44 (восстановитель)
0,54-(-0,44)=0,98
0,98>0
Выходит, что реакция идет
-
Известно, что
1. При взаимодействии 1,35 г неизвестного металла с прозрачным раствором выделятся бесцветный газ, который реагирует с кислородом и образует 0,9г жидкой воды
2. К образовавшемуся раствору приливают серную кислоту - образуется белый студенистый осадок, растворившийся в избытке кислоты.
3. Данный металл соединяется с хлором в соотношении 1:1,5 без остатка и имеет постоянную положительную степень окисления.
Определите металл. Напишите уравнения реакций.
РЕШЕНИЕ:
Это не одновалентный металл, так как при присоединении с хлором получалось бы соотношение 2:1
Это не двухвалентных металл, так как при присоединении с хлором получилось бы соотношение 1:1
ЭТО ТРЕХВАЛЕНТНЫЙ металл, при присоединении с хлором получается нужное соотношение 1 : 1,5
Подходит АЛЮМИНИЙ, так как он трехвалентный и имеет постоянную степень окисления.
Алюминий амфотерный, взаимодействует с кислотами и со щелочами.
При взаимодействии с прозрачным раствором (1 условие) выделяется газ, который взаимодействует с кислородом с образованием воды
Это водород.
Алюминий взаимодействует со щелочью (неизвестно с какой),продуктами реакции являются комплексная соль и водород
Далее эта комплексная соль взаимодействует с серной кислотой, должен образоваться белый студенистый осадок, делаем вывод, что кислота сначала взялась в недостатке
Уже потом к гидроксиду алюминия мы добавляем серную кислоту и происходит растворение осадка (это соответствует 2 условию)
Теперь уравнения реакций:
1) 2Al + 2 щелочь + 6 H20 = 2 X[Al(OH)4] + 3 H2 (X - неизвестный металл, который стоит в щелочи)
2) 2 H2 + O2 = 2 H20
3) 2 X[Al(OH)4] + H2SO4 = X2SO4 + 2 Al(OH)3 + 2 H2O ( кислота в недостатке)
4) 2 Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O
5) 2 Al + 3 Cl2 = 2 AlCl3
Металл- АЛЮМИНИЙ
Теперь надо понять какую именно щелочь нужно взять в 1 реакции
Обратимся к 1 условию, где дана масса воды и масса алюминия
Количество вещества воды равно (0,9 : 18 = 0,05 моль)
Количество вещества водорода равно количеству вещества воды = 0,05 моль (смотри 2 уравнение реакции)
Дальше не понятно, как определить щелочь
Нужно ли в этой задаче ее определить, играет ли это значение в задаче, если имеет не могли бы помочь с определением формулы щелочи
Заранее спасибо))
-
ВИДЫ ЧАСТИЦ В РАСТВОРЕ:
гидратированные ионы
гидратированные молекулы
гидратированные ионы и молекулы
молекулы
РАСТВОР ЧАСТИЦЫ В РАСТВОРЕ
K3PO4 гидратированные ионы
H2S гидратированные ионы и молекулы
NH4OH гидратированные ионы и молекулы
HF молекулы
NaCl гидратированные ионы
Ni(OH)2 гидратированные ионы и молекулы
Правильно?
Заранее спасибо)
-
2 мл. раствора одноосновной кислоты (содержащей водород и кислород с массовой долей больше массовой доли азота в 3,43 раза) с массовой долей растворенного вещества ω = 72% (р=1,43 г/мл) разбавили до 2 л.
Определите кислоту и вычислите pH полученного раствора с учетом активности.
Решение:w=Ar*n/Mr - массовая доля элемента, где Аr-относительная атомная масса элемента, n-количество элемента, Mr- молярная масса всего вещества
Одноосновная кислота, значит здесь 1 атом водорода
H Ny Oz , где y и z - количество атомов азота и кислорода соответственно
Mr=1+16z+14y
w(O)=16z/1+16z+14y
w(N)=14y/1+16z+14y
w(O)/w(N)=3,43
(16z/1+16z+14y):(14y/1+16z+14y)=3,43
16z/14y=3,43
z=3 и y=1
ИТОГО
HNO3
m растворенного вещества=p * V * w(растворенного вещества)=2*1,43*0,72=2 г
V (количество вещества)=m/Mr=2/63=0,0327 моль
Объем нового раствора=2002 мл
Молярная концентрация кислоты=0,0327/2002=1,63* 10^-5 моль/л
Азотная кислота-сильный электролит, диссоциирует нацело
HNO3 H+ + NO3-
Концентрация ионов водорода равна 1,63 * 10^-5 моль/л
найдем ионную силу раствора
I=1/2Cz^2
I=1/2*(1,63 *10^-5 + 1,63 * 10^-5)=1,5 *10^-5
найдем коэффиццент активности
lgf=-1/2*z^2*I^-1/2 (корень из ионной силы)
f=1
находим активность
a=f*c
a=1*1,63*10^-5=1,63*10^-5
pH=-lg a
pH=-lg1,63*10^-5=4,79
Не могли бы проверить ход и правильность решения
Заранее спасибо
-
Скажите пожалуйста, возможна ли такая реакция:
Mg(H2PO4)2 + 2 KOH = Mg(OH)2 + 2 KH2PO4
Если щелочь в недостатке и не концентрированная
-
При сжигании образца органического вещества массой 4 г получено 4,48 л (н.у.) С02 и 2,88 г Н2О .Известно, что данное вещество обесцвечивает бромную воду и вступает в реакцию с раствором Ba(OH)2 при нагревании, один из продуктов этой реакции имеет состав С6Н604Ba.Уставить органическое вещество и показать в структурном виде.
Может получится
1) С10Н1604 (сложный эфир, образованный непредельной двухосновной кислотой и этиловым спиртом)
2) С5Н802 ( сложный эфир, образованный акриловой кислотой и этиловым спиртом)
Какой из этих двух вариантов правильный?
Заранее спасибо)
-
Бензилформиат надо окислить перманганатом калия в кислой сере
бензилформиат+KMnO4+H2SO4=бензойная кислота+углекислый газ+ сульфат марганца 2+сульфат калия+вода
Как расставить недостающие коэффициенты?
-
На смесь карбонатов кальция, магния и бария массой 81,7 г подействовали соляной кислотой и получили 90,5 г смеси хлоридов. Какой объем углекислого газа (н.у.) при этом выделился? Ответ приведите в литрах с точностью до десятых. (Пример: 22,4)
Решение:
Данные реакции идентичны (данные карбонаты образованы металлами из одной группы)
Запишем обобщенное уравнение
XCO3+2HCl=XCl2+CO2+H2O
Обозначим количество веществ СаСO3, MgCO3, BaCO3 соотвество за x,y и z
Масса(СаСО3)=100x
Масса(MgCO3)=84y
Масса(BaCO3)=197z
Масса первоначальной смеси равна
100x+84y+197z=81,7 -1 уравнение
Масса(CaCl2)=111x
Масса(MgCl2)=95y
Масса(BaCl2)=208z
Масса смеси хлоридов равна
111x+95y+208z=90,5 - 2 уравнение
Система уравнений
100х+84у+197z=81,7
111х+95у+208=90,5
....
По математическим вычислениям: система имеет бесконечно много решений
Производство 12-оксистеариновой кислоты
в Общий
Опубликовано
Производится ли 12-оксистеариновая кислота в России? Если да, то какие заводы и в каком регионе они расположены?