
Ukt,P
-
Постов
142 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Ukt,P
-
-
Я понял ваше решение! Спасибо! А моё решение можете прокомментировать на верность рассуждений?
-
При 30 0С давление пара водного раствора сахарозы равно 31,207 Торр. Давление пара чистой воды при 30 0С равно 31,824 Торр. Плотность раствора равна равна 0,9954 г*см-3. Чему равно осмотическое давление этого раствора. Я смог написать решение данной задачи, но с ответом не сходится, и я не вижу ошибки. Моё решение:
По закону Рауля находим мольные доли веществ. Мольная доля сахарозы равна 0,01939. Тогда примем что объём раствора 1 л. Тогда масса раствора 995,64 г. Отсюда составляем систему, зная молярную массу сахарозы.
18х+342y=995,64
y/x+y=0.01939
Отсюда y равен 0,795. Следовательно, осмотическое давление равно 0,795*8,314*303=2002 кПа
Правильный ответ: 26,9 атм.
Помогите найти ошибку. Заранее спасибо!!!
-
Хорошо!!! Спасибо!
-
При 50 оС количество нативной формы рибофлавина превышает количество денатурированной в 390 раз, а при 100 оС - в 6 раз. Рассчитать энтальпию реакции денатурации рибофлавина. Я рассчитал по уравнению изобары Вант-Гоффа (ln(Kp2/Kp1)=ΔrH/R*(1/T1-1/T2)) и у меня получилось ΔrH=-83428 Дж*моль-1. Правильный ответ ΔrH=122,9 кДж*моль-1.
Я уже несколько раз пересчитал - не сходится. Помогите разобраться! Заранее спасибо!!!
-
Спасибо за ответ!!!!
-
А без энтальпии нельзя как-то определить температуру, при которой степени диссоциации данных веществ равны?
-
1. При температуре 1396 К и общем давлении 1 бар степень диссоциации водяного пара на простые вещества равна 5.67*10–5 , а степень диссоциации диоксида углерода – на монооксид и молекулярный кислород – 1.55*10–4 . а) Определите состав водяного газа, образовавшегося из равных количеств монооксида углерода и водяного пара при этих условиях. (3 балла) б) Найдите парциальное давление молекулярного кислорода в системе, описанной в п. а.
2. При какой температуре степени диссоциации H2O и CO2 станут одинаковыми?
Можете, пожалуйста, помочь в решении 2 пункта. Я знаю уравнение изобары Вант-Гоффа, но чтобы его применить нужно знать энтальпию каждой реакции. Можете подсказать, как её вычислить, не используя справочных данных? В интернете есть решение этой задачи, но там не понятно, как рассчитывается энтальпия.
https://cdn.bc-pf.org/olympiads/chemistry/rus_sbory/2014-Jun/theory_sol.pdf
-
Спасибо!
-
Произведение растворимости гидроксида железа (III) равно 4*10-38. При каком рН начнётся выпадение осадка Fe(OH)3 из сантимолярного раствора хлорида железа (III).
Моё решение заключалось в нахождении [OH-]. [OH-]=3*4^√(4*10-38/27)=5,88566*10-10→рН=14-(-lg(5,88566*10-10)=4,7698.
Правильный ответ: рН=2,2.
Можете объяснить в чём ошибка?
-
Спасибо!!!
-
Недавно я прочитал, что при изменении знака вращения в органических реакциях не говорит о изменении абсолютной конфигурации молекулы. Можете объяснить: почему знак вращения не связан с абсолютной конфигурацией?
-
В 15.02.2023 в 19:34, Lеоnid сказал:
А если мы разбавили в 108 раз, у вас будет рН = 8?
Я не говорю, что она будет равна lg(n). Изменение pH не достигает этого значения. В задаче не подразумевается бесконечное разбавление.
В 15.02.2023 в 19:56, MGM сказал:Если сказано что диссоциацией воды можно пренебречь, значит речь не идёт о бескончном разбавлении.
Конечно результат будет приблизительный, тем не менее.
При разбавлении раствора сильной кислоты в 10 раз, рН увеличится на 1.
Было 2 - стало 3. И в том и вдругом случае диссоциация воды подавлена и роли не играет
Для определения нижней границы используй формулу рН слабой кислоты, и смотри,
как она изменится, если концентрация кислоты станет в n раз меньше.Хорошо! Я попробую
Спасибо!!!
В 15.02.2023 в 19:34, Lеоnid сказал:А если мы разбавили в 108 раз, у вас будет рН = 8?
Вот как раз нельзя - она и определяет верхний предел, который →7 при бесконечном разбавлении.
Нижняя определяется несколькими факторами: растворимостью кислоты, диссоциацией и коэффициентом активности. Cкажем, для хлорной кислоты, при С = 10 М, α→1 и γ = 30, рН = -lg300 = -2,48.
Спасибо!!! Зато теперь знаю, что делать при бесконечном разбавлении
-
На сколько может увеличиться pH раствора любой одноосновной кислоты при разбавлении в n раз. Установите верхнюю и нижнюю границы для ΔpH. Диссоциацией воды при решении задачи можно пренебречь.
С верхней границей я разобрался, она равна lg(n). Помогите разобраться с нижней границей.
Заранее спасибо!!!
-
Понятно. Cпасибо!!! Значит связи в принципе никакой нет
-
Есть ли прямая зависимость между координационным числом элемента и его степенью окисления?
-
Спасибо!!!
-
Возможно ли получить анион Fe3Cl5-?
-
Спасибо! Я всё понял!!!
-
-
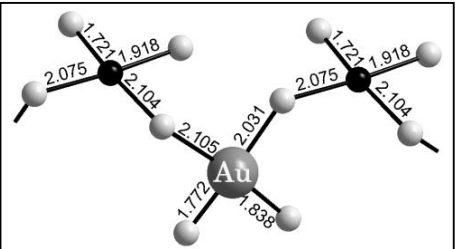
Здравствуйте! Помогите, пожалуйста, определить структуру соединения из файла ниже. И можете рассказать ход решения?
Известно, что соединение BF3 растворяет золото, и получается данное соединение.
-
Спасибо большое!!!
-
Здравствуйте! Можете сказать, как зависит константа равновесия от типа процесса (экзотермический и эндотермический) при увеличении или понижении температуры, давления или объёма? Заранее спасибо!!!
-
Спасибо!!!
-
В задаче представленной ниже в файле, рассчитывая теплоту реакции по уравнениям с разными коэффициентами, я получаю различные результаты. К примеру.
По уравнению 4С3H5N3O9→12CO2+6N2+O2+10H2O я получаю, что теплота реакции на 4 моль нитроглицерина 5447 кДж. Следовательно, на 1 моль нитроглицерина 5447/4=1361,75 кДж. А по уравнению C3H5N23O9→3CO2+1,5N2+0,25O2+2,5H2O я получаю, что теплота реакции на 1 моль нитроглицерина 1414 кДж. Можете, пожалуйста, объяснить c чем связана такая разница?
В 27.11.2022 в 18:54, Ukt,P сказал:В задаче представленной ниже в файле, рассчитывая теплоту реакции по уравнениям с разными коэффициентами, я получаю различные результаты. К примеру.
По уравнению 4С3H5N3O9→12CO2+6N2+O2+10H2O я получаю, что теплота реакции на 4 моль нитроглицерина 5447 кДж. Следовательно, на 1 моль нитроглицерина 5447/4=1361,75 кДж. А по уравнению C3H5N23O9→3CO2+1,5N2+0,25O2+2,5H2O я получаю, что теплота реакции на 1 моль нитроглицерина 1414 кДж. Можете, пожалуйста, объяснить c чем связана такая разница?
Задача на закон Рауля
в Решение заданий
Опубликовано
Спасибо!!!