-
Постов
188 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Shephard_316
-
-
Находите массу чистой руды=90.
Далее составляете пропорцию 90кг - 208 кг/кмоль
х кг - 96 кг/кмоль
Получается 41,5
-
Скажите, а в задаче про серебро нужно концентрацию раствора умножить на степень диссоциации и полученную концентрацию подставить в уравнение Нернста?
-
А в первой задачке нужно концентрацию умножить на степень диссоциации и полученное подставить в уравнение Нернста?
-
Помогите, пожалуйста
-
Это у Вас свинцовый сернокислотный аккумулятор? Естественно, в нем два электрода, для каждого пишется свое уравнение Нернста. ЭДС определяется как разность потенциалов электродов.
Вот и я думаю, что два разных уравнения.
А у меня в задании написано, составить схему этой электрохимической цепи и уравнение Нернста для этой цепи. Что это значит?
Может быть, такая форма записи? В таком случае

-
Спасибо.
А как можно написать уравнение Нернста для реакции Pb+PbO2 + H2SO4 = 2PbSO4 + 2H2O
У нас же выходит 2 электрода?
-
Здравствуйте. Не подскажите, как решить такую задачку:
стандартный электродный потенциал серебра равен 0,80 В. Вычислить потенциал серебра в растворе его соли, концентрация которого составляет 0,01 моль/л, а степень диссоциации при 18С равна 0,88.
-
Люди, скажите, что такое абсолютная и стандартная энтропия? И как энтропия зависит от температуры, объёма и агрегатного состояния системы?
-
И что? Вы не знаете, при какой t замерзает (кипит) вода?
Есть температура замерзания, есть значение понижения. Не найдете искомое?
Не дан, берите 1.
Хорошо, спасибо.
А можно для выражения процентного содержания произвольные числа взять?
-
Подскажите, как мне решить вот это, пожалуйста:
1) при какой приблизительно температуре будет кипеть 50%-ный раствор сахарозы. (E=0,52)
2) При какой приблизительно температуре будет кристаллизоваться 30%-ный раствор поваренной соли (K(H2O)=1,85)?
Я так поняла, нужно использовать следствия из закона Рауля? Но ведь там понижение или повышение температур, а не сами температуры. Плюс, во второй задачи у нас электролит, а изотонический коэффициент нам не дан? Не объясните принцип решения?
-
Да сколько угодно. Может быть даже бесконечно большой.
Спасибо!
-
Скажите, а может ли быть константа равновесия больше 1?
-
Использую формулу: (p0-p)/p0= X2, где X2 - мольная доля растворённого вещества. Получаю, что масса воды равна 600г. Значит, количество вещества воды примерно равно 33,3. Количество вещества глюкозы примерно равно 0,44. В итоге X2 равно 0,013. Подставляю в формулу и получаю, что 56000 - p=730 Па. А в ответе написано, что на 7,2кПа.
-
Здравствуйте. Не поможете с задачей:
давление над чистым растворителем (водой) равно 56кПа. На сколько понизится давление над раствором, если в 600мл воды растворили 80г глюкозы?
Использую закон Рауля, но при вычислениях получается какой-то бред.
-
Скажите, а, если у меня в задаче дан тепловой эффект реакции, то это и есть энтальпия, или энтальпия - это противоположная величина с другим знаком?
И, если дана теплота образования, к примеру, какого-либо вещества, то это сразу записывать как энтальпию или нужно сначала поменять знак?
-
Ой, спасибо вам большое!
-
Здравствуйте. У меня такой вопрос: как вычислить суммарную энергию Гиббса уравнения реакции, например, горения фосфористого водорода в кислороде, если известны энтальпии и энтропии всех веществ в реакции?
И как решить данные задачи:1. Вычислите ∆G° реакции
CaCO3 (кр) → CaO(кр) + CO2 (г)
Соединение
DН, кДж/моль
S, Дж/моль∙К
DG, кДж/моль
CaCO3 (кр)
– 1207
92,9
– 1128,35
CaO(кр)
– 634,9
38,1
– 603,46
CO2 (г)
– 393,51
213,6
– 137,15
При 25°С и 500°С. Может ли реакция протекать самопроизвольно при данных условиях?2.Вычислить стандартное изменение изобарного потенциала DG для реакции:C2H2(г) + 5/2O2 2CO2 + H2O(ж)
Соединение
DН, кДж/моль
S, Дж/моль∙К
CO2
– 393,51
213,6
H2O(ж)
– 285,84
69,95
C2H2(г)
226,75
200,8
O2
0
205,04
Может ли реакция протекать самопроизвольно при стандартных условиях?И вообще, не посоветуете хорошую, доходчивую статью по термодинамике с примером решения разных типов задач? -
Только формально, на бумаге, фактически, в одну стадию - никак.
Na2SO3 + I2 + H2O = H2SO4 + 2NaI
Спасибо!
-
Не подскажите, как получить серную кислоту в одну стадию из сульфита натрия?
-
Попались вот такие задачки:
1)Рассчитайте молярную массу эквивалента:
а) фосфорной кислоты в реакции полного обмена протонов водорода
Я составила уравнение с KOH, к примеру. У меня получилась молярная масса эквивалента примерно 32, 67
б) сульфата железа 3 при полном обмене ионов железа +3
Я составила уравнение с KOH, и у меня получилась молярная масса эквивалента примерно 66,67
в)гидрокарбоната кальция в реакции полного обмена ионов кальция
Я составила уравнение обмена с соляной кислотой. Молярная масса эквивалента - 81
2) Вычислить молярную концентрацию эквивалента вещества в растворе
а) C(H2SO4)=0,1 при факторе эквивалентности 1/2.У меня получилось 0,2
б) C(H3PO4)= 1 моль/л при факторе эквивалентности 1/3. К меня получилось 3.
в) C(KOH)= 0,25 моль/л при факторе эквивалентности 1. У меня вышло 0,25.
Скажите, пожалуйста, я правильно рассуждаю и мою ответы верны?
-
Грубо говоря, без учета определения и ряда оговорок, это частица вещества, соответствующая одной единице валентности.
ZnCl2. Двухалентный цинк, Э = 1/2 молярной массы.
AlCl3. Трехвалентный алюминий, Э = 1/3 М.
Al2(SO4)3. Два трехвалентного алюминия, Э = 1/2*3 = 1/6 М.
CrO3. Шестивалентный хром, Э = 1/6 молярной массы.
Спасибо большое!
-
Здравствуйте. Не могли бы вы мне объяснить, что ттакое эквивалент вещества на примере. А то в университете задали, а нормального объяснения найти не могу.
-
-
Здравствуйте, не могли бы вы мне растолковать, чем отличаются друг от друга электрофильные и нуклеофильные реагенты и реакции. Как определить, какой тип замещения характерен для тех или иных органических классов. В учебнике как следует не обьяснено, а в Интернете статьи слишком сложные. Не могли бы вы разьяснить мне попроще?


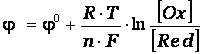
Физ. химия
в Решение заданий
Опубликовано
Товарищи, скажите, правильно ли я решаю следующие задачи:
1)Вычислит концентрацию ионов серебра в 0,1 М растворе [Ag(NH3)2]NO3, содержащем 1 моль/л аммиака.
Я думаю, нужно найти по справочнику константу нестойкости комплекса, подставить концентрацию раствора и аммиака и посчитать концентрацию ионов серебра. Это верно?
2)1.Энергия активация реакции О3(г) + NO(г) = O2(г) + NO2(г) равна 10 кДж/моль. Во сколько раз, изменится скорость реакции при повышении температуры от 27 до 37°С?
Я решаю по следствию из уравнения Аррениуса, но у меня получается, что скорость изменилась в 1 раз, то есть вообще не изменилась.
Что делать?