
ХАТАБЫЧ93
-
Постов
4 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные ХАТАБЫЧ93
-
-
А к кому обращаться с подготовкойВ общем-то дело такое, лето, как известно работу абитуре найти сложно. А книжки, посуда и реактивы разумеется на дороге не валяются.
Да решили мы с господином Qerik'ом, заняться без 5-ти минут собственный делом.
В общем-то идея есть такая. Создание проекта по подготовке к ЕГЭ по химии. Лично меня на это воодушевил проект http://ege-ok.ru/
Суть заключалось в следующем. Подробный материал на каждый тип задания. Подробный разбор типовых заданий. Видео уроки.
Весь материал для частей А и Б решили сделать в свободном доступе. И всего лишь часть С, сделать коммерческой.
Реализовываться это будет в простом сайте.
Раскрутка через социальные сети. Форумы о подготовки к ЕГЭ. Тема горячая, даже кормящая. Достаточно конкурентный сайт я видел только один. Да и тот нашпигован кучей неоформленной инфы.
В общем-то интересует ваше мнение.
Ах да забыл, может единомышленники есть.
Основной девиз кампании правда "Не заработаем, так благое дело сделаем", но все же. Попытка не пытка
-
А Хотченко у тебя нет
-

где комплекс
 разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
разбивается на x единиц A и y единиц B, константа диссоциации определяется так: 
где [A], и [AxBy] — концентрации A, B и комплекса AxBy соответственно,посмотри может по этой формуле
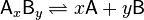
 разбивается на x единиц A и y единиц B,
разбивается на x единиц A и y единиц B, 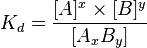
Заказ решения примеров задач
в Работа
Опубликовано · Изменено пользователем ХАТАБЫЧ93
Посмотри вот это.Правило Вант – Гоффа. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
где v2 и v1 - скорости реакции при температурах Т2 и Т1, γ - коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической. Для многих реакций γ лежит в пределах 2 – 4.
При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k. Правило Вант – Гоффа запишется так:
Уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
Эти два уравнения можно использовать лишь для ориентировочных расчетов, так как точность их не очень высока.
Уравнение Аррениуса
В 1889 г. шведский ученый Сванте Аррениус на основании экспериментов вывел уравнение, которое названо его именем
где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа для химических реакций лежат в пределах 40 – 400 кДж/ моль
После логарифмирования уравнение имеет вид
Если представить графическую зависимость lnk = f(1/T), то она имеет вид (рис 17).
Здесь tgα = -Еа/R и Еа = - Rtgα. Отрезок, отсекаемый на оси ординат равен lnА.
Итак, константа скорости реакции (и скорость) возрастает с увеличением температуры по экспоненциальному закону. В соответствии с уравнением Аррениуса константа скорости реакции уменьшается с ростом энергии активации. Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) при различных температурах
2) Во сколько раз увеличится скорость химической реакции при повышении температуры от 30 до 50* С, если температурный коэффициент реакции равен четырем ?
аналогично этой задачи получаем,следовательно, скорость реакции νТ2 при температуре 50оС больше скорости реакции νТ1 при температуре 30оС в 16 раз.