Поиск
Показаны результаты для тегов 'nacl'.
Найдено 13 результатов
-
Есть ли возможность предсказать , какая основная соль магния выпадет, если в растворе хлорид ЩМ или NH4, и MgSO4, и на дне в избытке MgO? 2NaCl+MgSO4+MgO=??? 2NH4Cl+MgSO4+MgO=??? То что при избытке MgO, из раствора и MgCl2 и MgSO4, выпадают осадки основных солей, я проверил. А вот когда в растворе и сульфат ион, и хлорид ион присутствуют, что выпадет, или просто смесь будет?
-
Уважаемые, как правильно протекает реакция между растворами NaCL и CuSO4? 1. CuSO4 + 2NaCL ==> CuCl2 + Na2SO4 2. CuSO4+4NaCl ==> Na2[CuCl4]+Na2SO4 Что из этого соответствует действительности?
-
Привет, прочитал книгу Поля Брегга, "Вся правда о воде и соли", в которой он довольно таки убедительно привел доводы о том, что соль нашему организму совсем не нужна и боеее того, она ни капельки даже не усваивается, сколь много бы мы ее не съели. Как объясняет автор, соль является неорганическим веществом, а тело наше способно поглащать только органику. И наш организм всеми силами пытается избавиться от соли, вымыв ее большим кол-вом воды. Так ли это на самом деле хочу разузнать у знатаков, у заядлых химиков этого форума)
- 6 ответов
-
- соль
- хлорид натрия
-
(и ещё 1 )
C тегом:
-
Вот идёт электролиз NaCl без диафрагмы. Со свинцом, на дно осыпаются оксиды типа сурика, и основные хлориды (весь шлам коричневого цвета), верно? Что в растворе? NaOH или NaClO3? Но со свинцовым анодом хлор выделяется в начале, и в середине реакции, и обильно, ближе к концу когда много уже свинца растворилось, хлора уже нет. Что тогда выделяется? А иногда хлор не выделяется вообще. А от свинца идут белые волны, наверное его гидроксида, почему? С медью, на аноде вообще ничего не выделяется. Медь растворяется, соединяется с ОН ионами и образует Cu2О оксид меди 1. И уходит на дно. Что в растворе? Спасибо. :-) Ну вот почему никто не хочет помочь? Причина? Есть ответ? Помогите пожалуйста SOS!
- 6 ответов
-
- медь свинец
- nacl
-
(и ещё 1 )
C тегом:
-
Доброе утро! Пожалуйста, подскажите, можно ли как-то в домашних условиях (реагенты доступные в обычном магазине / в аптеке) отличить хлорид калия от обычной соли? Дело в том, что я использую умягчитель для воды, который использует соль для очистки своей "мембраны". Умягчитель установлен так, что сбрасываемый таким образом использованный раствор может попадать на газон и под деревья. Для приготовления раствора я покупаю солевые "таблетки" в мешках по 25 кг - здесь (кипр) они продаются без указания состава, написано просто "Специальная соль для умягчителей воды / Special Salt for water softeners". При этом я знаю, что таблетки могут быть сделаны и из NaCl, и из KCl, но если второй состав является удобрением для растений, то первый наоборот может привести к заражению земли, с которым будет сложно справиться. На вкус таблетки просто соленые, без дополнительных привкусов. Не уверена, что правильно выбрала раздел, но буду благодарна за любую помощь в этом вопросе!
-
Здравствуйте, В университете задали собрать аккумулятор и мы определились на газовом аккумуляторе Преснякова. Два карбоновых электрода , обмотаны мешочками с активированным углем(абсорбентом ), опущены в 15% раствор NaCl. Суть в том, что при подачи напряжения на электроды выделяется хлор и гидроген, которые впитываются активированным углем. Разность в потенциалах этих двух газов создает напряжение, которые позже можно использовать, как аккумулятор. Я нашел много информации с конкретными числами, но нигде нет расчетов. Здесь более подробно расписано: http://batareyki.105mb.ru/prostoy_akkum.html Формула реакции: 2NaCl + 2H2O -> H2 + Cl2 +2NaOH. Во всех источниках сказано, что заряжать нужно при напряжении 4.5 Вольта, но по моим рассчетам 2.5 Вольта достаточно. Подскажите, как это правильно посчитать? Меня также интересует ток, которым стоит заряжать. Влияет ли это как-то? Как посчитать напряжение и емкость в А*ч после заряда? Насколько это опасно? Насколько я знаю, хлор в виде газа достаточно опасный. Прошу помочь и извинить за ,может быть, глупые вопросы для химиков. Первокурснику, который изучает сенсорные технологии это сложно дается) Буду рад любому совету!
- 16 ответов
-
- газовый аккумулятор
- электролиз
-
(и ещё 3 )
C тегом:
-
Друзья,прошу у вас помощь в размышлениях. Сам-то я бум-бум в химии,поэтому хотелось бы услышать ответ от умных людей.Люблю выращивать кристаллы,и вот где-то 2 недели назад делал маточный раствор.Обычно он как делается,берется соль,кипяток,заливается это всё дело.Если соль не вся растворилась-готово.Но я решил немного изменить условия приготовления маточного раствора,я взял соль,бросил её в кастрюлю,налил воду(не горячую),и начал греть на электроплите.Грел,грел и,когда соль не растворялась уже,я снял с плиты,и сразу профильтровал.На следующий день прихожу-глаза круглые.У меня всегда обычно или на дне были малюсенькие кубы или вообще почти ничего не было,а тут,что-то на подобие иголок.Ну,если говорить более по правде и точнее,в форме палочек от снежинки.Кто нибудь может подсказать что произошло,ибо я знаю,что монокристалл кубический,поликристалл тоже что-то наподобие,но никак не ветка снежинки(ну точнее её кусочки).Ну то есть вы поняли,я изменил условия,там я сразу делал маточный раствор,а тут на протяжении получаса,может меньше.Надеюсь на вашу помощь
-
Провел такой опыт. В два сосуда с крепким раствором NaCl опустил медные пластинки, к которым подвел 9 В. Сосуды соединил узкой полоской фильтровальной бумаги, пропитанной тем же раствором. В середину полоски капнул медицинский спиртовой раствор йода. Через несколько минут появился от пятна шлейф в сторону плюса батареи. А через час пятно почти исчезло. Возник вопрос: смещается ли йод к плюсу, или просто со стороны минуса он быстрее переходит в какую нибудь невидимую HI ?
-
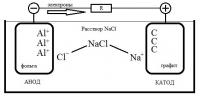
Заранее извиняюсь, я не химик по профессии, так что не будьте строги. Я тут заинтересовался самодельными батарейками. И занялся конструированием самой простой с солевым раствором в качестве электролита. Меня интересует какие химические продукты выделяющиеся в гальваническом элементе состоящим из соляного раствора NaCl•H2O и электродов из алюминия (фольга) и графита. Могу предположить следующее: 1.Натрий оседает на катоде (углероде, точнее графите) и не вступает с ним в реакцию. Хлор также оседает, но на аноде (алюминий, в моем случае фольга) и не вступает с ним в реакцию. 2. Либо... Далее натрий осевший на катоде реагирует с водой: 4Na + O2 +2H2O = 4NaOH И щелочь NaOH реагирует с алюминием (что мне кажется маловероятно): 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑ Или хлором, который осел на катод (что мне кажется более вероятным): 2NaOH + Cl2 = NaClO + NaCl + H2O А хлор, частично, вступает в реакцию с алюминием и в результате AlCl3 выпадает в осадок. И далее, AlCl3 реагирует со щелочью: AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Мой элемент длительное время способен выдавать напряжение в 0.3 вольта, но если периодически протирать графит, то напряжение возрастает примерно в двое, до 0.6 вольт, но очень скоро падает до 0.5. А через час, после протирания, падает до 0.3 вольт. Правда это все без нагрузки (если не считать сопротивление старенького вольтметра). При том, что если протирать фольгу, то особого подъема напряжения я не заметил. Далее, я заметил, что можно и не протирать катод, а сделать два катода соединенного одним проводом.При этом в то время как первый катод находится в растворе, второй сушится на воздухе. Когда напряжение падает до 0.3 то, если их поменять местами, вижу, что напряжение возрастает до 0.5, но в течении пары минут падает до 0.4. И если каждый раз так менять катоды с периодом в семь минут, то напряжение меньше 0.35 вольт не упадет. Я так подумал, а что если катодов будет не два а пять, к примеру, то время смены можно уменьшить, а среднее напряжение возрастет. Про это я сумел найти только то, что при прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. С тем же эффектом можно второй катод и не вынимать из раствора, а лишь провод коннектить то с одним, то с другим катодом... То есть если сделать некий электронный прерыватель работающий на той же батарейке которую он и регулирует, который переключатся между катодами, то напряжение можно усреднить и до 0.5 вольт. Я не физик, и не так хорошо знаком с электроникой, но мне кажется это очень интересным Итак, мои вопросы: 1. Почему так происходит с двумя катодами? 2. Какие все же реакции протекают в таком элементе?
-
Хочу получить натрий электролизом раствора NaCl через лампу без нагрева раствора. Какое напряжение и сила тока для этого потребуются чтобы получить 1 грамм за сутки?
- 111 ответов
-
См. фото
-
Доброго времени суток!!! Решыл с помощю електролиза повареной соли получить NaOH в колбе: солевой раствор, и перекись водорода. подключил под батарею типа "крона" = 9 вольт также к ним подключил мультиметр . вопрос почему на мультиметре постоянно падает напряжение с 1,5 вольта при нагрузке..сечас 0,75 и почему в колбе очень много бурого цвета
- 26 ответов
-
- електролиз соль
- NaCl
-
(и ещё 1 )
C тегом:
-
раствор содержит 0.37 г HCl, 0,12 г NaCl и 0,29 г Na2SO4 в 1000 г воды. Вычислите pH этого раствора.