
snz-fisher
-
Постов
154 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные snz-fisher
-
-
-
Но там нет ответа, я смотрела Оо
m(Br2) = M(Br2) * [m(3-броманилина) / М(3-броманилина)]
-
-
1.CH3-CH2-CO-NH2 + KOBr =
2.CH3-CH2-CH2-CH=N-NH2 + KOH тв =
1) расщепление амидов щелочным гипобромитом или гипохлоритом (реакция Гофмана). Промежуточными соединениями в этой реакции являются изоцианаты, и этот метод можно использовать для их получения:
-
СH2-CH(OH)-CH3 ----> CH3-CHCl-CH3 ----> (CH3)3CH - CH(CH3)8
1) + HCl
2 - вещество написано неправильно
-
не сочтите за наглость, а ионный ее вид можно записать?
Полное ионное: 2Na(+) + SO4(2-) + Pb(2+) + 2CH3COO(-) = 2Na(+) + 2CH3COO(-) + PbSО4
Сокращенное ионное: Pb(2+) + SO4(2-) = PbSO4
Общий принцип составления: всё что хорошо растворяется (смотри в таблице растворимости) раскладываешь на ионы, остальное записываешь в молекулярном виде. При этом получаешь полное ионное уравнение. Потом сокращаешь одинаковые ионы в левой и правой частях и получаешь сокращенное ионное.
-
Na2SO4 + Pb(CH3COO)2 = PbSO4 + Na(CH3COO)2 реакция неверна?
Реакция верна, один из продуктов написан неверно
Как ее правильно написать?
Na2SO4 + Pb(CH3COO)2 = PbSO4 + 2 NaCH3COO
-
я просто не знаю как здесь разместить структурную формулу=) там бензольное кольцо и снизу связь СНО
Ну так это и есть бензальдегид, там 6 водородов
-
1) CaO + 3C = CaC2 + CO (при повыш. темп.)
2) CaC2 + 2H2O → HC ≡ CH + Ca(OH)2
3) HC ≡ CH + H2O → H3C - CHO (катализатор Hg2+)
4) а) СH3 - CHO + [O] = CH3 - COOH (окисление)
б) CH3 - COOH + CH3OH = CH3 - COO - CH3 + H2O (в кислой среде)
-
Химические св-ва 2 метил- 3 этил пентановой кислоты
Помогите пожалуйста
Все свойства карбоновых кислот
-
осуществить превращения
какие
-
Формула 2 метил- 3 этил пентановой кислоты
CH3 - CH2 - CH(C2H5) - CH(CH3) - COOH
то что в скобках пиши вниз на отдельной связи (то есть не в основной цепи)
-
Пожалуйста вычислите рН а)в 0,1Н растворе H2SO4. б)в 0,1Н растворе СН3СООН;
Кд=1,8*10в степени -5
Для серной кислоты 0,1Н соответствует 0,05М, то есть 0,05 моль/л ионов водорода (диссоциация у нее полная). pH = -lg (0,05)
Для уксусной кислоты концентрация ионов водорода будет равна квадратному корню из произведения концентрации на константу диссоциации. Нормальность и молярность у нее равны, так что можно использовать сразу концентрацию 0,1. Получится 0,00136. А рН = -lg (0,00136)
-
Определите окислитель и восстановитель, расставьте коэффициенты пользуясь методом составления электронно – ионных полуреакций:
Cr2 (SO4)3 + Br2 + KOH -> K2CrO4 + KBr + K2SO4 + H2O
Сr(3+) + 8 OH(-) -3e → CrO4(2-) + 4H2O | 2
Br2 + 2e → 2Br(-) | 3
2Cr(3+) + 3Br2 + 16OH(-) = 2CrO4(2-) + 6Br(-) + 8H2O
Cr2(SO4)3 + 3Br2 + 16KOH = 2K2CrO4 + 6KBr + 3K2SO4 + 8H2O
-
не может быть ОВР, варианты ответа
б) обратимый гидролиз;
в) конпропорционирование;
г) необратимый гидролиз.
-
-
В б и в - с солянкой будет реагировать по аминогруппе с образованием хлорида замещенного аммония, а с аммиаком - по карбоксильной, с образованием аммонийной соли соответствующей кислоты, либо амида (при нагревании), других вариантов не вижу
Напишите уравнения следующих реакций:
а) трионина с динитрофторбензолом (днф)
б) гутаминовая кислота с HCl
в) алланин с аммиаком
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце.

-
Через 100 г. 19,6 %-ного раствора серной кислоты пропустили аммиак, при этом образовалась только кислая соль. Определить массовую долю соли в полученном растворе.
H2SO4 + NH3 = NH4HSO4
n(H2SO4) = 100 г * 0,196 / 98 г/моль = 0,2 моль
n(NH3) = n(H2SO4) = 0,2 моль (если бы аммиак был взят в избытке, то получилась бы не только кислая соль)
m(NH3) = 0,2 моль * 17 г/моль = 3,4 г.
Если аммиак взят в недостатке, то в принципе тоже образуется только кислая соль, но там возможны варианты
n(NH4HSO4) = n (H2SO4) = 0,2 моль
m(NH4HSO4) = 0,2 моль * 115 г/моль = 23 г
m (р-ра) = 100 + 3,4 = 103,4 г
w(NH4HSO4) = (23г/103,4г)*100% = 22,2 %
-
1. укажите формулу высшего оксида химического элемента третьего периода VI группы системы Менделеева:
1) SO3 2)SiO2 3) Al2O3 4) SO2
2/ Неметаллические свойства в следующем ряду элементов:
P - As - Sb - Bi
1) усиливаются 2) не изменяются 3) ослабевают 4) изменяются переодически
3. Какую степень окисления проявляет хром в оксиде, имеющем формулу CrO3?
1) -4 2) -2 3) +3 4) +6
4. Галогенами называют вещества группы
1) F2, Cl2, Br 2
2) Hcl, HBr, Hl
3) Si, O2, N2
4) NH3, H2S, H4C
5. Реакция уравнение которой BaO + H2O = Ba(OH)2 относится к реакциям
1) соединения
2) обмена
3) замещения
4) разложения
6. Уравнение реакции обмена:
1) 4Al + 3O2 -> 2Al2O3
2) 2KOH + H2SO4 - > K2SO4 + 2H2O
3) MgCO3 - > MgO + CO2 ^
4) Ca + 2 HCl -> CaCl2 + H2 ^
7. К физическим свойствам явления относится
1) разложение воды электрическим током
2) скисание молока
3)горение свечи
4) испарение воды
8. Сумма коэффицентов перед всеми формулами электролитов в молекулярном уравнении реакции по схеме:
Fe + H2SO4 - > FeSO4 + H2
1) 5
2)2
3) 3
4) 4
9. лампочка прибора для испытания на электрическую проводимость НЕ ЗАГОРИТСЯ при погружении электродов в
2) раствор хлорида калия
4) раствор серной кислоты
10. Диссоциация сернистой кислоты H2SO3 является обратимой реакцией, так как эта кислота
1) слабый электролит
2) изменяет цвет индикатора
3) растворима в воде
\4) сильный электролит
11. Вещ-ва,которые при диссоциации образуют в качестве катионов ионы водорода и металла, являются
1)кислотами
2) кислыми солями
3) щелочами
4) средними кислотами
12. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции углекислого газа с избытком раствора гидроксида натрия равны
1) 9 и 3
2) 10 и 5
3) 9 и 5
4) 10 и 3
13. Укажите название щелочи
2) гидроксид меди (II)
3) гидроксид аллюминия
4) гидроксид натрия
14) К основным оксидам относится
1)SiO2
2) P2O5
3) BaO
4) SO3
15. Формула растворимой в воде соли
1) CaCO3
2)BaSO4
3) MgCO3
4) Na2SO4
16. Карбоксильная группа содержится в молекулах
1) метанола
4) этина
17. Этилен взаимодействует с
1)этанолом
2) углекислом газом
3)гидроксидом меди (II)
13411244112343434
-
-
- Объясните суть донорно-акцепторного механизма образования ковалентной связи. В молекуле K3[Fe(CN6)] укажите:
- донор и акцептор;
- комлексообразователь и лиганд;
Суть донорно-акцепторного механизма заключается в том, что у одного атома (акцептора) есть свободная квантовая ячейка (орбиталь, не занятая электронами), а у другого (донора) - свободная, неподеленная пара электронов. При образовании связи акцептор предоставляет донору свободную орбиталь, а донор акцептору - пару электронов. Таким образом образуется общая электронная пара. Конечно очень поверхностно объяснил, но в общем суть должна быть ясна.
В данном случае акцепторром будет ион Fe(3+), а донором - цианид-ион
- Объясните суть донорно-акцепторного механизма образования ковалентной связи. В молекуле K3[Fe(CN6)] укажите:
-
1М ZnCl2 . Электроды из Pt. Определить количество вещества, полученных на электродах и разложившихся в электролите, если количество прошедшего через электролит электричества равно 26,8 А.ч . Выход по току равен 80%
Подскажите пожалуйста, по каким формулам нужно производить расчет
Так у тебя дана масса глицерина...
-
помогите плиз
Два хлора заменяй на кислород с двойной связью и будет тебе альдегид или кетон, здесь уравнения писать неудобно;
При окислении цепь рвется рядом с карбонильной группой, при этом она окисляется в карбоксильную, а крайний углерод второго "куска" молекулы также окисляется в карбоксильную группу.
-
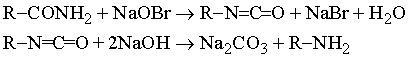

Определение вещества
в Решение заданий
Опубликовано
по-моему исходное - пропилендиамин