
Артур Шепард
-
Постов
8 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Артур Шепард
-
-
Октетные формулы дополняют обычные структурные формулы представлениями о природе химических связей, позволяют использовать для описания реакционной способности периодический закон и его следствия, однако они мало помогают решению вопросов, связанных с реакционной способностью и механизм нами реакций.
а вот и сама формула

или


Пойдёт?)
-
Нифига меня осенило в универе...решил её, только вот я так понял
kukin010 это был ответ (50,006 мл)...не обратил внимания сразу)))
Решил я правильно...почти...у меня получилось 0,50006 л...те где-то 500 мл...но быстро нашел ошибку. Если кому надо будет, скину решение)
Четверка в зачетке имеется)
-
Ой...всю ночь не спал от написанного ещё хуже запутался)) Просто уже "котелок" не варит...пойду на экзамен без неё)
-
Во спасибо) Вторую я решил (извиняюсь за качество)http://vk.com/simps_on?z=photo36013678_283649739%2Falbum36013678_00%2Frev
А вот первую поясните пожалуйста!
-
Нашёл.
Перманганатометрию используют в следующих целях :
1 Определение. Еслимежду определяемым восстановителем и МnО4-протекает быстро, то титрование проводят. Так определяют,,, железо (II),, мышьяковистую кислоту и др., например:5Н2О2 + 2МnО4- + 6Н+ → 5О2 + 2Мn2+ + 8Н2О,
5[Fe(CN)6]4- + МnО4- + 8Н+ → 5[Fe(CN)6]3- + Мn2+ + 4Н2О,
5АsIII + 2МnО4- + 16Н+ → 5Аsv + 2Мn2+ + 8Н2О.
В случае замедленных реакций определение проводят способомизбытка перманганата.Так определяют, поли- и оксикарбоновые кислоты,и другие органические соединения, например:НСОО-+ 2MnO4-+ 3OH-→ CO32-+ 2MnO42-+ 2Н2OЗатем избыток перманганата оттитровываютили:2MnO4- + 5C2O42- + 16H+ → 2Mn2+ + 10CO2 + 8H2O
2 Определение. Добавляют избытоквосстановителя и затем титруют его остаток растворомKMnO4(способ). Например,,,и другие окислители можно определять перманганатометрическим методом, подействовав сначала избытком стандартного раствора Fe2+, а затем оттитровав непрореагировавшее количество Fe2+раствором KMnO4:Cr2O72- + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H 2O
Титрование избытка ионов Fe2+проводят перманганатом ():5Fe2+ + MnO-4 + 8H+ → 5Fe3+ + Mn2+ + 4H2O.
3 Определение веществ, не обладающих окислительно-восстановительными свойствами, проводят косвенным способом, например. Для этого определяемый компонент переводят в форму соединения, обладающего восстановительными или окислительными свойствами, а затем проводят титрование. Например, ионы кальция, цинка, кадмия, кобальта осаждают в виде малорастворимыхМ2+ + С2О42- → МС2О4¯.
Осадок отделяют от раствора, промывают и растворяют в H2SO4:МС2О4 + Н2SO4 → H2C2O4 + MSO4.
Затем H2C2O4() титруют раствором KMnO4:5С2О42- + 2MnO4- + 16H+ → 10CO2 + 2Mn2+ + 8H2O.
4 Определение органических соединений. Отличительной особенностью реакций органических соединений с MnO4-является их малая скорость. Определение возможно, если использовать: анализируемое соединение предварительно обрабатывают избытком сильнощелочного раствора перманганата и дают возможность реакции протекать необходимый период времени. Остаток перманганата титруют раствором оксалата натрия. Например, при определениипротекают реакции:C3H5(OH)3 + 14MnO4- +20 OH- → 3CO32-+ 14MnO42- + 14H2O,
2MnO4- +5C2O42- + 16H+ → 2Mn2++ 10CO2 + 8H2O.
-
Назовите их пожалуйста...возможно я не умею искать, либо не могу отличить бред от правды, так, как везде пишут разное в зависимости от раздела химии. Спасибо.
-
1.
Какой объем 0.1 н раствора щелочи надо прибавить к 10 миллилитрам 0.5 н раствора кислоты, чтобы довести его pH до 9?
2.
Для растворения 1 г иодида свинца PbJ2 при 18*С требуется 1470 мл воды. Найдите произведение растворимости этой соли.
Не могу решить и всё, а это лаба на допуск к экзамену на сессии =( Может быть я пропустил эту тему =)
Заранее огромное спасибо!
з.ы. попытка номер 3....

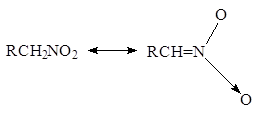

какой механизм реакции CH3C=0-CH2-CH2-C=O-CH3 = 3-метил-циклопент-2-ен-1-он
в Решение заданий
Опубликовано
Для сложных реакций, состоящих из неск. стадий (простых, или элементарных реакций), механизм - это совокупность стадий, в результате к-рых исходные в-ва превращаются в продукты. Промежуточными в-вами в этих реакциях могут выступать как молекулы, так и свободные атомы, ионы, радикалы, ион-радикалы, карбены, электроны, возбуждённые частицы. Стехиометрия, ур-ние сложной реакции как правило не отражает её механизм. Элементарные реакции классифицируют по числу частиц, подвергающихся превращению в элементарном акте (моно-, би-, тримолекулярные реакции). В механизм элементарной реакции входят также физ. процессы передачи энергии, к-рые лежат в основе активации и дезактивации реагирующих частиц. Выяснение М. х. р. необходимо для того, чтобы управлять реакциями - влиять на их скорость и направление.
Вроде это ЭЛЕМЕНТАРНАЯ РЕАКЦИЯ так как участвует один элемент 3-метил (основной).