-
Постов
50 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Alexium
-
-
При гидролизе и декарбоксилировании образуются углекислый газ и ацетон на которые приведены качественные реакции. Сам ацетилацетонат обладает свойствами енолов и таутомерией на что проводятся вторая группа реакций.
Вот у меня возникла мысль что это не этиловый эфир ПВК, а метиловый эфир ацетоуксусной, просто мучают сомнения по поводу декарбоксилирования ПВК до ацетона. И про кето-енольную форму ПВК тоже возникают сомнения
-
а что тот другой пост, в котором собственно и предположили что это этиловый эфир пировиноградной кислоты? вам там подсказали что это может быть он, объяснили явления, а вы тут теперь пишите как свои мысли. маленький, но плагиат. реакция называется не йодоформной, а галоформной. сначала в присутствии серной, отлетает эфир, а потом при нагревании идет декарбоксилирование.
Да в другом посте предположили, то есть идет декарбоксилирование ПВК до этаналя? Я пытаюсь подвести к итогу все задание, кстати я тут нашел:
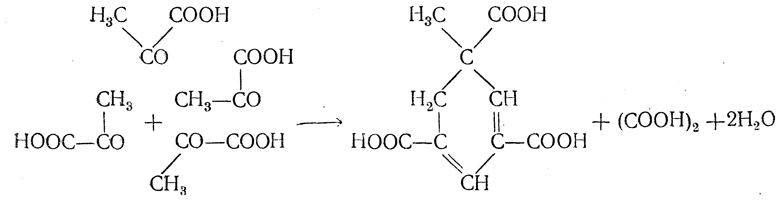
При нагревании солей пировиноградной кислоты с баритовой водой или с едким натром происходит конденсация пировиноградной кислоты с отщеплением щавелевой кислоты и образованием циклической (гидроароматической) метилдигидротримезиновой кислоты:

Метилдигидротримезиновая кислота может терять СО2 и, окисляясь, переходить в симметрическую метилизофталевую, или увитиновую, кислоту.
а что тот другой пост, в котором собственно и предположили что это этиловый эфир пировиноградной кислоты? вам там подсказали что это может быть он, объяснили явления, а вы тут теперь пишите как свои мысли. маленький, но плагиат. реакция называется не йодоформной, а галоформной. сначала в присутствии серной, отлетает эфир, а потом при нагревании идет декарбоксилирование.
Так же вот:
5.1. Кето-енольная таутомерия ацетоуксусного эфира.В пробирку вносят 1—2 капли ацетоуксусного эфира и приливают 2 мл дистиллированной воды. Смесь энергично перемешивают и добавляют 1 каплю 2%-ного раствора хлорида железа (III). Постепенно развивается фиолетовое окрашивание, которое свидетельствует о наличии енольной группы в растворе ацетоуксусного эфира. Хлорид железа (III) образует с енольной формой окрашенное комплексное соединение.
При добавлении нескольких капель бромной воды раствор обесцвечивается, так как бром присоединяется по двойной связи, и гидроксильная группа утрачивает енольный характер:


Через некоторое время раствор вновь окрашивается в фиолетовый цвет, так как связывание енольной формы нарушает динамическое равновесие, и часть оставшейся кетонной формы ацетоуксусного эфира переходит в енольную, образующую окрашенный комплекс с ионами Fe3+. В енольную форму может также переходить монобромацетоуксусный эфир. При повторном добавлении бромной воды снова наблюдают обесцвечивание раствора с последующим возобновлением фиолетовой окраски. Этот процесс может продолжаться до полного замещения подвижных атомов водорода на бром, т. е. до получения дибромацетоуксусного эфира, не способного к таутомерным превращениям.

-
Ну да, но что бы нагреть до 300°С, надо сначала нагреть до 170°С. Хотя дальше идет такая реакция
(NH4)2SO4 = NH4HSO4 + NH3 235-357° C
в сумме при 300°С должно быть так
4(NH4)2SO3 = 3NH4HSO4 + 5NH3 + H2S
Хорошо спасибо, если что еще спрошу.
-
-
Возьмем к примеру этиловый эфир ПВК. Если продукты гидролиза (не могу составить реакцию, что бы в продуктах был СО2) в присутствии серной кислоты пропустить через склянки с баритовой водой и щелочным раствором йода, то в первом случае выпадет объемный осадок белого цвета (почему я и сказал про СО2, осадок вероятно карбонат бария), а во втором случае выделяется желтоватый осадок, обладающий неприятным запахом (тут наверняка йодоформная реакция).
В тоже время при взаимодействии данной жидкости с раствором хлорида железа (III) наблюдается сине-фиолетовое окрашивание, характерное для соединений совсем другого класса. При добавлении к полученному раствору бромной воды происходит его немедленное обесцвечивание, которое через несколько минут восстанавливается и вновь исчезает при добавлении новой порции брома. (вот здесь вообще не понимаю)
Напишите схемы всех описанных реакций и приведите систематические названия органических соединений. Объясните экспериментальные факты, приведенные в последнем опыте. Какое распространенное химическое явление легло в основу этой задачи?
-
-
-
Подскажите, вот дана реакция
C6H5-(CO)-NH2+NaOBr=C6H5-NH2+NaBr+CO2
Необходимо описать механизм ее протекания.

-
XN2Cl + H3PO2 + H2O = XH + N2 + HCl + H3PO3
А не можете подсказать как назвать C6H5-(CO)-NH2? C6H5-NH-(CO)-CH3? И механизм реакции декарбоксилирования с использованием гипобромита натрия
-
углекислота это рабочее название двуокиси углерода и ничего с ней не будет
Окай, а как она отщепится? Декарбоксилированием? Тогда в реакции получится так что этиловый эфир ПВК + вода= EtOH + СО2+этаналь?
-
кстати косячок мой. при гидролизе серной кислотой идет отщепление углекислоты, поэтому в первой склянке будет карбонат бария
Так углекислота ж неустойчива и разложится и как она отщепится от молекулы?
-
PV=mRT/M (разделим обе части на m)
P=ро*R*T/M
ро=
Необходимо отдельно посчитать ро водорода и смеси и потом поделить? А ро не пойдет в знаменатель?
-
я про 8-ую реакцию говорил. Да не важно уже.
А я хочу уточнить про 9-ую, ведь если изначальное вещество другое, то и в реакции немножко по другому ведь
-
конечно, в конце учтёте. Из ур-ия Менделеева- Клапейрона.
Хорошо, попробую
конечно, в конце учтёте. Из ур-ия Менделеева- Клапейрона.
Как мне связать температуру из Клайперона?

-
метилацетоацетат
А какие реакции? Если при гидролизе образуется ацетоуксусная кислота и метиловый спирт?
после гидролиза в присутствии серной кислоты образовалось 2 соединения...первое при реакции с баритовой водой дало осадок...ну походу сама кислота(карбоновая) во второй склянке желтоватый осадок (галоформная реакция)-йодоформ....значит был этанол. и выходит имеем дело с этиловым эфиром пировиноградной кислоты. енольная форма оного (бидентантный лиганд) дает окрашивание с солями Fe3+ , а бром как то разрушает окрашенный комплекс.
А можете привести примерную реакцию окрашивания с хлоридом железа?
-
в 9-й поправили [X]OH на [X]Cl. Теперь всё верно.
в 8-й теперь тоже правильно, но Вы, мне кажется, так и не поняли.
Существование продукта [n-Me-Ph-NN]OH в кислой среде (HCl или H2SO4 - без разницы) невозможно.
А вот [n-Me-Ph-NN]Cl или [n-Me-Ph-NN]2SO4 - возможно.
Да я просто уравнения составлял не на думающую голову, то есть в девятой поменять реагент и в продуктах вместо воды будет соляная кислота?
-
А что в восьмой может быть? Просто в условии стоит H+, я и подумал. Там наверно вот так? R—NH2 + 2HCl + NaNO2
 R—N2Cl + NaCl + 2H2O
R—N2Cl + NaCl + 2H2OА в 9-ой что?

-
пара-метил
= PhCOOH
= PhCOOEt
= PhCONH2
+ NaOBr - NaBr - CO2 = Ph-NH2
= Ph-NH-C(O)-CH3
= n-Me-Ph-NH-C(O)-CH3
= n-Me-Ph-NH2
= [n-Me-Ph-NN]+ (соль диазония)
= n-Me-Ph-OH
= толуол.
Вот так вот?

-
= PhCOOH
= PhCOOEt
= PhCONH2
+ NaOBr - NaBr - CO2 = Ph-NH2
= Ph-NH-C(O)-CH3
= n-Me-Ph-NH-C(O)-CH3
= n-Me-Ph-NH2
= [n-Me-Ph-NN]+ (соль диазония)
= n-Me-Ph-OH
= толуол.
А что имеется ввиду под понятиями n и Me?
-
до каких соединений, по-Вашему, она гидролизуется?
Значит это не левулиновая
-
-
Установите строение соединений А-З. Напишите схемы превращений, как называется реакция превращения соединения В в соединение Г, укажите условия и механизм ее протекания. Предложите, если есть варианты образования вещества Д из В.
Толуол --(KMnO4, H+, t)--> А --(EtOH, H+, t)--> Б --(NH3, t)--> В --( ?, t)--> Г --(CH3COCl, t)--> Д --(CH3I, AlCl3, t)--> Е --(NaOH, H2O, t)--> Ж --(NaNO2, H+, t)--> З --(H3PO2)--> Толуол
-
Неизвестная жидкость состава C5H8O3, ИК-спектр которой свидетельствует о наличии в ее структуре кето-группы, ведет себя двулично. Если продукты ее гидролиза в присутствии серной кислоты пропустить через склянки с баритовой водой и щелочным раствором йода, то в первом случае выпадет объемный осадок белого цвета, а во втором случае выделяется желтоватый осадок, обладающий неприятным запахом. В тоже время при взаимодействии данной жидкости с раствором хлорида железа (III) наблюдается сине-фиолетовое окрашивание, характерное для соединений совсем другого класса. Самое удивительное, что при добавлении к полученному раствору бромной воды происходит его немедленное обесцвечивание, которое через несколько минут восстанавливается и вновь исчезает при добавлении новой порции брома.
Напишите схемы всех описанных реакций и приведите систематические названия органических соединений. Объясните экспериментальные факты, приведенные в последнем опыте. Какое распространенное химическое явление легло в основу этой задачи?
Есть предположение, что C5H8O3 это левулиновая кислота.
Заранее спасибо!
-
Вроде нормальные, коэфф. не проверял.
Да на них то ладно, спасибо!









Извлечение ценных металлов в виде исходных соединений
в Решение заданий
Опубликовано
Одним из лабораторных методов синтеза слоистых
перовскитоподобных оксидов является высокотемпературный
твердофазный метод. Например, соединение RbNdTa2O7 получается этим
методом из Rb2CO3, Nd2O3 и Ta2O5. Однако, при нарушении
температурного режима синтеза, продукт может получиться с заметными
примесями. Такой продукт непригоден для дальнейших исследований, но
выбрасывать его жалко, поскольку он содержит достаточно редкие и
дорогие элементы.
Основываясь на химических свойствах соединений рубидия,
неодима и тантала, предложите метод их извлечения из 10 г «плохо
получившегося» RbNdTa2O7 в виде исходных реагентов (Rb2CO3, Nd2O3,
Ta2O5) с максимальной чистотой, максимальным выходом и, по
возможности, с использованием максимально простого лабораторного
оборудования. Можете ли вы предложить метод, который по затратам*
не будет превосходить стоимость этих реактивов в соответствующем
количестве?
* цены реактивов рекомендуется смотреть на сайте
http://www.sigmaaldrich.com. Стоимостью амортизации оборудования и оплаты
рабочего времени можно пренебречь.
Есть идея с использованием гидроксида рубидия с последующим образованием гидроксида неодима и получением оксида, а вот с рубидием электролиз расплава остатка соли, т.е. Rb4Ta2O7. Потом в щелочь и +CO2. А с танталом даже не знаю