Поиск
Показаны результаты для тегов 'физическая химия'.
Найдено 60 результатов
-
Как тепловой эффект растворения связан с энтальпией растворения?
Michael77 опубликовал вопрос в Вопрос-ответ
Ответьте на вопрос пожалуйста (из лабораторной работы "определение теплоты растворения соли"):Как тепловой эффект растворения связан с энтальпией растворения? -
При переходе вещества (пары этого вещества подчиняются законам идеального газа) из жидкого состояния в газообразное при температуре Т и давлении 1,01×10^5 Па расходуется теплота парообразования. Принять, что теплота испарения не зависит от температуры. Вычислите изменение энтропии, энергии Гиббса, энергии Гельмгольца, внутренней энергии, энтальпии и работу расширения 1 моль вещества в этом процессе. Определите изменение перечисленных функций, если пары 1 моль вещества А нагреваются от температуры Т до (Т+25 градусов) : А) изохорически Б) изобарически На сколько градусов поднялась бы температура вещества, если бы изменение внутренней энергии при переходе из жидкого состояния в газообразное выражалось в повышении температуры? Вещество :HCI, T=189 К
-
Доброго времени суток! Помогите решить задачу, пожалуйста Используя табличные данные, рассчитать теплоту реакции Mg(OH)2 (тв) = MgO (тв)+ H2O пар, протекающей в открытом сосуде при 400 К и давлении 101,3 кПа. Как будет отличаться от этого значения теплота данной реакции, проводимой при той же температуре, но в закрытом сосуде? Считать Ср, т = С°р, 298.
-
Итак, обещанная тема! В ней будут публиковаться задачки олимпиад краевого и выше уровней для тренировки. Краевая олимпиада 2001 - 2002 года, 10 класс, теоретический тур, Краснодарский край Задание 1 (15 баллов) Твёрдое при комнатной температуре вещество А содержит 50% (мол.) водорода. Оно не реагирует с водным раствором перманганата калия, а при действии бихромата калия в 30% растворе серной кислоты превращается только в кислоту Б, содержащую 58.5% углерода и 3.7 % водорода. Выделения газа при этом не наблюдается. При нагревании кислота Б плавится, после чего теряет воду и образует вещество В. Если А обработать нитрующей смесью при слабом нагревании, то среди многочисленных продуктов нитрования преобладают 3 соединения (Г, Д и Е) в соотношении по массе 1:1:1, с трудом поддающиеся разделению. Все эти соединения содержат 49,5% углерода, 3,1% водорода и 14,4% азота. При окислении любого из этих трёх соединений кислым раствором бихромата калия образуется только одно вещество - кислота Ж. Укажите вещества А - Ж и напишите соответствующие превращения. Задание 2 (12 баллов)При полной нейтрализации 200 мл соляной кислоты с массовой долей 0,0352 (p=1036 кг/м3) раствором КОН выделилось 11,18 кДж теплоты (условия стандартные). В реакции нейтрализации 500 мл 0,1 М уксусной кислоты при тех же условиях выделилось 2,38 кДж. 1) Определите молярную теплоту диссоциации воды. Ответ обоснуйте. 2) Предложите способ (теоретический или экспериментальный) определения молярной теплоты диссоциации воды. 3) Как меняется величина ионного произведения воды с ростом температуры. Ответ обоснуйте. Задание 3 (10 баллов) Элемент Х образует множество кислородсодержащих кислот. Содержание (в процентах по массе) калия, элементаХ и кислорода в калиевых солях некоторых из них приведено в таблице: 1) определите Х 2)запишите молекулярные и графические формулы кислот, дайте их названия и названия солей, указанных в условии. Задание 4 (8 баллов) При взаимодействии 1,0000 г сложного эфира некоторой органической кислоты с избытком раствора гидроксида натрия было получено 1,1356 г натриевой соли этой кислоты. 1) Установите формулу сложного эфира. 2) Составьте кинетическое уравнение и рассчитайте, во сколько раз увеличится скорость гидролиза эфира, если концентрацию эфира увеличить в3 раза, а концентрацию щёлочи в 4 раза. Медленной и равновесной считать 1-ю стадию присоединения ОН к эфиру. Задание 5 (5 баллов) Неизвестный металл массой 4,8 г обработали избытком очень разбавленного раствора азотной кислоты. К полученному раствору прибавили избыток раствора щёлочи и нагрели, при этом выделилось 1,12 л газа (н.у.). Определите металл, напишите уравнения реакций Задание 6 (4 балла) Осуществите следующие превращения:
- 1439 ответов
-
- Органическая химия
- Неорганическая химия
- (и ещё 7 )
-
Система: капля алюминия, капля ацетонитрила. Все это в объеме гексана. Капля алюминия постепенно переходит в каплю ацетонитрила. Радиус капли алюминия постоянен, радиус капли ацетонитрила постепенно увеличивается соответственно. Необходимо получить зависимость свободной поверхностной энергии от глубины погружения капли алюминия в каплю ацетонитрила и опеределить минимум свободной энергии. Принимаем, что капли сферические.
-
Помогите пожалуйста решить задачу... Выразить скорость необратимой реакции как функцию степени превращения исходных веществ для гомогенной реакции взаимодействия гидроксида натрия с этилацетатом NaOH + СН3СООС2Н5 =>CH3COONa + С2Н5ОН. Спасибо !
-
- кинетика
- химические процессы
- (и ещё 3 )
-
Сама я в физ химии не очень от слова совсем, но мне нужно разобраться со следующей задачей: у меня идет реакция первого порядка, идет в изотермических, изобарных условиях, для нее известны для нескольких температур протекания реакции – константы скорости реакции (при 40С k=0,00267 ч-1, при 60С k=0,0058 ч-1, при 80С k=0,0384 ч-1). Каким образом на основании этих данных рассчитать энергию Гиббса, при этом, желательно, так, чтоб уравнения были не безумно заумными? Пока что то, на что натыкалась- жуткая теория, не имеющая к практике никакого отношения(
-
Сама я в физ химии не очень от слова совсем, но мне нужно разобраться со следующей задачей: у меня идет реакция первого порядка, идет в изотермических, изобарных условиях, для нее известны для нескольких температур протекания реакции – константы скорости реакции (при 40С k=0,00267 ч-1, при 60С k=0,0058 ч-1, при 80С k=0,0384 ч-1). Каким образом на основании этих данных рассчитать энергию Гиббса, при этом, желательно, так, чтоб уравнения были не безумно заумными? Пока что то, на что натыкалась- жуткая теория, не имеющая к практике никакого отношения(
- 10 ответов
-
- энергия гиббса
- физхимия
-
(и ещё 1 )
C тегом:
-
В сосуд, содержащий 0,001 м^3 воды при 20° С, погружена железная пластинка массой 10 г, нагретая до 200° С. Чему равно изменение энтропии, если Ср(Fe)= 25,52 Дж/г-атом*град, Ср(H2O)=77.82 Дж/моль*град?
-
- физхмия
- физическая химия
-
(и ещё 2 )
C тегом:
-
1) Приведите уравнение изотермы адсорбции, учитывающее неоднородность поверхности поглотителя и дайте пояснения. 2) На основании каких данных можно рассчитать константу равновесия электрохимической реакции при постоянной температуре. Вот вообще не знаю что отвечать на эти вопросы. Рылся в конспекте - нашел дулю без мака... Кто, что знает по этим вопросам, поделитесь своими знаниями или где можно посмотреть эти вопросы, а то в интернете слишком много шлака под видом ответов...
-
Здравствуйте! Подскажите, пожалуйста, где можно найти диаграмму "температура кипения - состав" для системы H2O - C2H4O, буду премного благодарен. UPD: формула С2Н4О соответствует окиси этилена.
- 11 ответов
-
- диаграммы
- температура кипения состав
- (и ещё 1 )
-
Рассчитать коэфициент активности компонента и др.
Тетрагидроканнабинол опубликовал тема в Решение заданий
Не знаю как ответить на эти вопросы. Перерыл весь доступный интернет в поисках ответов, но так и не нашел внятных объяснений. 1) Приведите термодинамические характеристики идеальных, регулярных и реальных растворов. Приведите примеры этих растворов. 2) Запишите условия кипения разбавленного раствора и чистого растворителя. 3) Рассчитайте химический потенциал компонента реального раствора. Какие варианты стандартных состояний вам известны? 4) Рассчитайте коэффициент активности компонента с высоким значением его концентрации в растворе. Каков физический смысл этой величины? Подскажите какие формулы использовать для 3 и 4 номера -
-
- 9 ответов
-
- физическая химия
- естественный процесс
- (и ещё 2 )
-
Объясните, пожалуйста, как решить эти задачи. Очень мало времени, если было бы больше -- смогла бы разобраться сама, а так пока этого не изучала.
-
- физическая химия
- ле шателье
- (и ещё 2 )
-
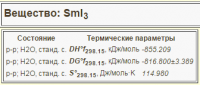
Подскажите значения теплоемкости и коэффициенты уравнения Cp=f(T) трийодида самария , самария и йода .
-
При 18°С эквивалентная электрическая проводимость иодистоводородной кислоты при бесконечном разведении λ∞ =38,4 Ом-1*м2*к-экв-1, а удельная электрическая проводимость HI (с=0,406 м-экв/л) равна χ=13,32 Ом-1*м-1. Каково значение активности ионов водорода в растворе?
-
- активность ионов
- физическая химия
- (и ещё 1 )
-
Как решить задачи по вычислению теплового эффекта реакций?
Tatiana20 опубликовал тема в Решение заданий
1)Теплота сгорания c2h5oh равна -1367,7 кдж. Найдите теплоту образования этилового спирта ,если пригорении образуются углекислый газ и вода в жидком состоянии? 2)вычислите тепловой эффект реакции при постоянном давлении при 25градусах С 2 NH4Cl+H2SO4ж= (NH4)2SO4т+2HClт 3)при нейтрализации 6,86 серной кислоты едким натром до образования гидросульфата натрия выделяется 4,32 кдж теплоты,а при нейтрализации этого же количества теплоты до ульфата натрия выделяется 9,26 кдж теплоты . Вычислите тепловой эффект взаимодействия гидроульфата натрия с едким натром. 4)Определите теплоты образования при постоянном объеме и 25 °С, если известна теплота образования при постоянном давлении для следующих реакций: а) Н2 + 1/2O2 = Н2О(Г), ∆H10 = - 242 кДж; б) 1/2N2 + 3/2Н2 =NН3, ∆H20 = - 46,2 кДж; в) 1/2H2 + 1/2F2 = HF, ∆H30= - 268,8 кДж; г) 1/2N2 + О2 = NО2, ∆H40 = 33,87 кДж. 5)Вычислите теплоту образования серного ангидрида, исходя из следующих данных: РbО + Sромб + 3/2О2 = PbSО4, ΔH10 = - 693,3 кДж; РbО + H2SO4·5Н2О = PbSO4 + 6Н2О, ΔH20 = - 97,55 кДж; SO3 + 5Н2О = H2SО4·5Н2О, ΔH30 = - 172,1 кДж. -
-
В реакциях , сопровожд-ся уменьшением числа молей, с увеличением давления и при постоянной температуре, следов-но при той же константе равновесия степень диссоциации уменьшается. Почему, если Т = Const?,то константа равновесия не меняется? И каким образом влияет давление на степень диссоциацию? У меня предположение, возможно, это бред. В общем, я подумала, что Н2 и О2 ввиду их малой массы,по сравнению с массой воды, начинают быстро двигаться при нагревании, и поэтому число их столкновений тоже велико. отсюда и сдвиг равновесия в сторону образования воды. если это не так, то объясните,пожалуйста, что на самом деле происходит. И почему влияние объема противоположно?
- 10 ответов
-
- физическая химия
- степень диссоциации
- (и ещё 1 )