
Тинаева
-
Постов
60 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Тинаева
-
-
Бензол замерзает при 278,68 К и кипит при 353,25 К. Его энтальпия испарения при температуре кипения равна 394,5 Дж/г. Раствор, содержащий 12,8 г нафталина в 1000 г бензола, замерзает при 277,867 К. Определить: 1)чему равно давление пара бензола над этим раствором при 353,25 К?; 2) чему равна удельная энтальпия плавления бензола?
1) для того , чтобы посчитать давление воспользуемся формулой Р(бензола)=Р0(бенз)*Х(бенз)
х= 1-Х(нафт)=0,99 моль
как теперь найти р0? // при температуре кипения давление паров чистого растворителя равно атмосферному давлению
можете взять 101325 Па
2) удельную энтальпию рассчитываю по формуеле: Нпл=RT^2замерз* m/(T0-Tзамерз), но ответ получается неверный, в чем ошибка?
//кто знает, что вы подставляете в эту формулу ... Что, например, вы понимаете под буквой m?
2) R= 8.314
T - температура замерзания растворителя ( бензола Т=278,68)
m - моляльность, которую я нашла, используя формулу : m=n/mр-ля, где n- количество вещества нафталина,т.е m= 0,1/1кг=0,1 моль/кг
дельта Т= T0-T= 278,68-277,867=0,813К
А теперь подставляем :
H=(8,314*278,68^2*0,1*0,078)/0,813
0,078- молярная масса бензола
-
Вот найдя парциальные давления каждого газа и используя закон Генри в форме ki = Pi/xip,
где xip - мольная доля растворенного газа, а Pi - его парциальное давление в воздухе
вы сможете найти мольную долю газа в растворе
Смотрим для азота:
PN2 = 101325*0,782 = 79236 Па
xN2(p) = PN2/kN2 = 79236/8,68*10^9 = 9129*10-9 = 9,13*10-6 .
Хотите моляльность? Пожалуйста:
Берем 1 моль раствора, в нем будет содержаться 9,13*10-6 моль азота.
При таком низком содержании растворенного вещества
это практически чистая вода, ее масса будет равна 18 г = 0,018кг
Моляльность Сm = n/m = 9,13*10-6/0,018 = 507*10-6 = 5,07*10-4 моль/кг
Проверка по данным растворимости азота
приводит к весьма близкому значению: 5*10-4 моль/кг
поняла,спасибо большое!)
-
Бензол замерзает при 278,68 К и кипит при 353,25 К. Его энтальпия испарения при температуре кипения равна 394,5 Дж/г. Раствор, содержащий 12,8 г нафталина в 1000 г бензола, замерзает при 277,867 К. Определить: 1)чему равно давление пара бензола над этим раствором при 353,25 К?; 2) чему равна удельная энтальпия плавления бензола?
1) для того , чтобы посчитать давление воспользуемся формулой Р(бензола)=Р0(бенз)*Х(бенз)х= 1-Х(нафт)=0,99 моль
как теперь найти р0?2) удельную энтальпию рассчитываю по формуеле: Нпл=RT^2замерз* m/(T0-Tзамерз), но ответ получается неверный, в чем ошибка?
-
Надо разбираться с вашими коэффициентами. К какой форме закона Генри они относятся, для какого способа выражения концентрации.
Возможно для такой k= P/x,
где х - мольная доля растворенного газа
Найдя мольную долю можно найти и моляльность
Вот это мне непонятно, что вы сделали.
Парциальное давление каждого компонента находится по формуле pi = P*xi
Где P - общее давление, в задаче не упоминается, но можно взять 101325 Па
хi - мольная доля компонента в воздухе
pi=p*xi - закон Рауля (применим для растворителя), у нас же азот и кислород - вещества, растворённые в каком-то объёме воды(в каком не указано) т.е. для них применим закон Генри р2=k2*x2. по условию у нас известны мольные доли растворённых веществ и их константы Генри, единственная связь между константой генри и мольной долей - это давление. нам требуется найти моляльность азота и кислорода. Cm= n/m, где n-кол-во растворенного в-ва(моль),m-масса растворителя(кг), т.е. воды. и того: у нас нет ни количества веществ, ни массы веществ, ни массы воды. нашла только давление каждого из веществ, что делать дальше не пойму
-
K(N2)=8,68*10^9 Па
K(O2)=4,4*10^9 ПаЗакон Генри: С = kP - k -коэффициент учитывающий природу газа (табл.?)
K(N2)=8,68*10^9 Па
K(O2)=4,4*10^9 Па -
Молярные доли азота и кислорода в воздухе при температуре 298 К составляют 0,782 и 0,209. Каковы концентрации (в моляльностях) в сосуде с водой, оставленном открытым на атмосферном воздухе при 298 К?
По закону Генри нашла давление каждого из компонентов. Теперь нужно как то перейти к массе, а точнее к количеству, как это можно сделать?
-
Потому что просят найти молярный объем раствора
поняла,еще раз спасибо!
-
-
Ничего Вам этого не нужно.
A =
 niai, где А это любая функция системы, а а парциальная величина
niai, где А это любая функция системы, а а парциальная величинаа количество вещества? нам опять масса нужна ведь, чтобы его рассчитать
на плотность уже умножала, ничего не получается
-
В 20%-ном растворе метилового спирта парциальные молярные объемы воды и спирта соответственно равны 18 и 37,8 см3 /моль. Определить молярный объем раствора.
Не пойму как мне рассчитать массу раствора. я сначала нашла плотность по формуле: p=100/ ((1-w)*(V1/M1)+ w*(V2/M2))
но для того , чтобы найти V мне нужна масса раствора (V=m/p), -
Давление пара жидкого брома изменяется с температурой по уравнению: lgP= -2210/T - 4,08 lgT +21,945 [P] = Па. Найти: 1) уравнение зависимости энтальпии испарения брома от темпера- туры; 2) изменение энтропии при испарении 1 моль брома при температуре кипения (332,35 К). Помогите решить, пожалуйста.
Для того , чтобы избавиться от десятичного логарифма все умножила на 2,303. Но в итоге получается натуральный логарифм ( не пойму как от него избавиться). Уравнение нужно продифференцировать по Т, опять же не пойму как именно это будет выглядеть. Помогите разобраться.) -
-
Вас спрашивают про 300 г, а не про 1 моль. Чего же ради надо умножать на молярную массу?
Ну просто единицы измерения странные получились Дж/К , а обычно теплоёмкость измеряется Дж/моль*К либо Дж/г*К
В целом ход решения правильный? -
Подскажите , пожалуйста, правилен ли ход решения? Сомневаюсь насчёт удельной теплоёмкости , так как я умножила Ее массу. Правильно ли это? Или ее нужно было умножать на молярную массу? И если да, то зачем нам тогда масса в условии.
-
Молярная энтальпия испарения четыреххлористого углерода изменяется с температурой по уравнению H (T) = 45857 – 44,06T (Дж/моль). Опреде- лить давление насыщенного пара CCl4 при 333 К, если известно, что CCl4
кипит при 349,9 К под давлением 101,325 кПа.
Для решения данной задачи нужно воспользоваться уравнением Клайперона- Клаузиуса
Ln(p2/p1)= dH/R * (1/T1-1/T2)
Возможно глупый вопрос, но как избавиться от логарифма?
И надо ли дифференцировать по Т уравнение с энтальпией?
Буду благодарна за помощь!)
-
Сначала у вас горячая вода и лед - хорошо бы найти суммарную энтропию этих двух состояний
Когда все закончится у вас будет 400 г теплой воды при некоторой конечной температуре
Хорошо бы найти эту Тконечную и энтропию этой теплой воды
Разница между энтропией конечного состояния и начального даст вам искомое изменение энтропии
Возможен второй подход
Энтропия горячей воды уменьшится при охлаждении до конечной температуры ΔS1<0
Энтропия льда увеличится за счет плавления и затем при нагревании полученной воды от 0 до Ткон. ΔS2>0, ΔS3>0
Сумма всех трех эффектов даст искомое
если рассматривать 2й способ, то не понятен такой момент: какой промежуток интегрирования будет в 3й реакции( нагревание полученной воды)? от Т1 до 363,15? и если да, то что будем интегрировать? у нас даже данных нет
энтропию плавления льда я нашла по формуле m* Hпл/T, где Т- температура плавления льда
энтропию охлаждения воды- проинтегрировав выражение m* Сp* dT/T в промежутке от 363,15 до T1
Возможно я ошибаюсь
Можете чуть-чуть поподробней объяснить, пожалуйста?
-
Рассчитать изменение энтропии при добавлении 200 г льда при 273,15 К к
200 г воды при 363,15 К в изолированном сосуде. Энтальпия плавления льда равна 333,46 Дж/г. Молярная теплоемкость воды 75,5 Дж/(Кмоль).
Для чего нам масса воды , если и так уже дана молярная теплоёмкость?
Я запуталась в решении этой задачи. Возможно, этот ход решения неверный. Я думала, что в этой задаче энтропию можно рассчитать как сумму энтропий для каждого обратимого процесса, но процесс то у нас и так обратимый. Каковы будут ваши мнения?)
-
Рассчитать изменение энтропии при добавлении 200 г льда при 273,15 К к
200 г воды при 363,15 К в изолированном сосуде. Энтальпия плавления льда равна 333,46 Дж/г. Молярная теплоемкость воды 75,5 Дж/(Кмоль).
Для чего нам масса воды , если и так уже дана молярная теплоёмкость?
Я запуталась в решении этой задачи. Возможно, этот ход решения неверный. Я думала, что в этой задаче энтропию можно рассчитать как сумму энтропий для каждого обратимого процесса, но процесс то у нас и так обратимый. Каковы будут ваши мнения?)
-
Неверно второе слагаемое интегрированной функции.
На мой взгляд оно должно выглядеть так:
25,1*10-3(373-273)
Третье слагаемое, на мой взгляд надо еще поделить на 2
Да, верно, 2е нужно взять как вы сказали) а вот насчёт третьего могу поспорить)
Степень стоит Т^(-2) , поэтому как у меня будет)
Спасибо большое)
-
Как думаете, ход решения правильный?
Если нет, то тогда где ошибка
В ответе получается 200,85 Дж /К*моль
-
Так , вроде же, написано в задаче, что Н2О (р.) - это же раствор или что?
нет нет, это газ написано))
Формула неверна. Вы что там воду растворяете что ли? Она испаряется.
Надо рисовать схему (многоугольник Гесса), изображающую все процессы, о которых идет речь в задаче и решать задачу по этой схеме.
Что-то вроде этого:

(это общая картинка, в вашей задаче она будет смотреться иначе)
Смотреться она может так:

Тогда по правому треугольнику, используя закон Гесса вы можете найти энтальпию гидратации MgSO4,
затем по левому - энтальпию разложения кристаллогидрата с образованием паров воды.
сейчас попробую, спасибо большое)
-
-
Ну да, конечно, плоскости симметрии у квадрата?
Плоскость симметрии - [/size]плоскость, делящая симметричную фигуру на две равные части, из которых одна представляет собой зеркальное подобие другой. [/size]
а вы такой умный я смотрю, что в итоге на вопрос и не ответили. Вокруг да около все ходите.Ну да, конечно, плоскости симметрии у квадрата?Плоскость симметрии - [/size]плоскость, делящая симметричную фигуру на две равные части, из которых одна представляет собой зеркальное подобие другой. [/size]
-
Сколько плоскостей симметрии имеет квадрат?
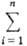 niai, где А это любая функция системы, а а парциальная величина
niai, где А это любая функция системы, а а парциальная величина








Физическая химия
в Решение заданий
Опубликовано