
Stasiiana1
-
Постов
33 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Stasiiana1
-
-
В 16.01.2023 в 19:31, Paul_S сказал:
Да.
Спасибо
-
В 16.01.2023 в 21:12, Shizuma Eiku сказал:
(NH4)2[Zr(SO4)3]+4NH4OH->Zr(OH)4+3(NH4)2SO4
Или ZrO2*nH2O вместо Zr(OH)4 по желанию.
Спасибо большое!
а вы не знаете еще, что тут получится:Uo2(no3)2+Zn+H(+)?
Как понимаю zn(0) уйдёт в zn (2+)u(+6) - в u(+4)
но какие продукты?
-
(nh4)2[zr(so4)3] + nh4oh
-
В 16.01.2023 в 18:51, Paul_S сказал:
Конечно.
Спасибо
а в этом случае до гидроксида циркония, да?
(nh4)2[zr(so4)3]+ nh4oh
-
Hg(NO3)2 + 4KCN → K2[Hg(CN)4] + 2KNO3
-
В 11.01.2023 в 03:52, MGM сказал:
Ну из формулы x*y2=1,6*10-5 найдите, чему равен y если х=0,1?
Спасибо
-
-
В 10.01.2023 в 16:22, MGM сказал:
Ну хоть что-то, хотя и коряво:
Дан объем раствора нитрата свинца 50 мл и концентрация 0,1 (каких едениц??? см? сек? грамм?) будем считать моль/л
Осаждение соли PbCl2 начнётся, когда произведение концентраций соотв. ионов станет больше ПР(PbCl2) = 1,6*10-5
ПК = [Pb2+]*[Cl-]2 > ПР.
Поскольку концентрация соли вам дана, т.е. [Pb2+]=0,1 моль/л, можно расчитать концентрацию [Cl-],
а зная объём раствора (50 мл) и навеску NaCl, для достижения такой концентрации.
Для практически полного осаждения следует добавить количество соли,
рассчитанное по уравнению реакции. Пишем и считаем.То есть конц [Сl-]=(0,1)^2 М?
-
В 10.01.2023 в 10:55, MGM сказал:
Чтобы твой вопрос был понятен, давай полное условие задачи,
а не обрывкиДан объем нитрата свинца 50
мл и концентрация 0,1. Найти массу nacl в начале осаждения и полного осаждения
-
В 10.01.2023 в 10:45, MGM сказал:
При титровании с м-о многоосновная кислота титруется по первой ступени, с образованием кислой соли
Если смесь кислот, то оттитровывается только сильная кислота.
С фенолфталеином многоосновная кислота титруется до средней соли,
а в смеси сильной и слабой кислот титруются обе кислоты.
О, поняла, спасибо
В 10.01.2023 в 09:43, Вадим Вергун сказал:Такое обычно дают для многоосновных кислот или для смеси.
Да, тут как раз задача про смеси
В 10.01.2023 в 04:17, бродяга_ сказал:надо брать крайний диапазон индикатора. они ведь весьма разные для фф щелочной
а этот кислотный.
то есть вместо цифр рН в условие внесли разные индикаторы.
тут как раз наоборот. для фф понадобится больше щелочи.
Поняла, спасибо
-
Как это использовать в решении, если я вижу в условии, что, например, на титрование аликвотной части было затрачено 10 мл, допустим, щелочи в присутствии метилового оранжевого, а в присутствии фф- 5 мл. Что нам это дает для решения?
-
Допустим, у нас есть две соли - K2So4 и ba(no3)2 (объем=50
мл, С=0,1 М)
как найти массу сульфата калия в начале осаждения и после полного?
насколько понимаю, находим сначала n(ba(no3)2)=50*0,1/1000А дальше что? Просто по ню искать?
-
В 10.01.2023 в 02:21, MGM сказал:
"0,1 нормального раствора" значит, что концентрация равна 0,1 моль-экв/л
Следовательно, в 2 л р-ра - ??? сколько?
Спасибо, уже заметили ошибку)
-
В 10.01.2023 в 01:29, aversun сказал:
HCl*0.1*2/0.25/1.18 = 24.7 мл
Спасибо
-
Сколько мл 25% HCl с p=1,18 г/см3 необходимо взять, чтобы получить 2 л 0,1 нормального раствора?
оцените правильность решения, пожалуйстаТак как эквивалент hcl=1, можно нормальность раствора заменить на молярность
в 2 л р-ра- 0,1 моль HCl
в 100 г р-ра - 25 г hcl
x- 3,65 г (36,5 г/моль*0,1 моль)
x=14,6 г раствора
V=14,6/1,18=12,37 мл
-
В 09.01.2023 в 14:07, MGM сказал:
Концентрация соли вам дана: "с концентрацией соли 0,1 моль/л " дан объём "300 мл раствора"
по формуле n=C*V без труда находите количество вещества соли (моль) и её массу.
Далее используем формулу для рН буферного раствора
pH=pKa-lg((Cк-ты)/(Cсоли)) находим отсюда Cк-ты в моль/л
зная объём раствора находите ее массу и объём 85% р-ра содержащего эту массу кислоты
всё!! Без всяких трёх неизвестных!
Спасибо большое!
-
Какой объём h3po4 W=85% по массе с плотностью 1,70 г/см3, а также какую навеску kh2po4 нужно взять, чтобы получить 300 мл раствора с ph=4 с концентрацией соли 0,1 моль/л?
как я решаю:
1) c1v1(кислоты)+c2v2(соли)=с3v3 (смесь)
по W=85% находим в справочнике См=14,63 М (так можно делать?)
pH используем в формуле буферного раствора
2) ph=pka-lg((Cv)кислоты/(CV)соли)
Внесем все известные данные в формулы:
1) 14,63*V(кислоты)+mсоли/136=0,3*Cp-pa
2) 4=2,15-lg(14,63*Vкислоты/(mcoли/136))
это по идее можно было бы объединить в систему, но три неизвестных для двух уравнений не решается, поэтому снова обращаюсь за помощью…
-
Здравствуйте, решаю задачу по частям (надеюсь, когда-нибудь научусь видеть решение) и остановилась на расчете pH буферной системы h3po4 и kh2po4.
надо использовать формулу:
pH=pka-lg((CV)кислоты/(СV)соли)
по какой ступени pka брать? По первой же, да?
-
В 08.01.2023 в 08:31, Lеоnid сказал:
А вы мыслите логически. Скажем, в ходе решения определено, что в аликвоте содержится 0,1 М вещества (например). Аликвота 25 мл взята из колбы 250 мл. Ну очевидно же, что в колбе вещества будет больше в 250/25 = 10 раз, т.е. Vк/Va.
Наоборот я, кстати, не встречал, но если такое и есть, обычная логика тут работает.
Спасибо!
В 08.01.2023 в 13:46, Arkadiy сказал:Я формулу сам составляю, если такая нужда вдруг возникла.
Количество эквивалентов вещества титранта, пошедшего на титрование, должно быть равно количеству эквивалентов вещества в титруемой пробе.
Исходя из этого пишется формула и делается расчет
Поняла, спасибо
-
В 07.01.2023 в 03:18, Arkadiy сказал:
с молекулярный массы титранта и титруемого вещества и количества молей, пошедших на титрование
А вот, допустим, есть какие-то формулы, которые пригождаются в большинстве случаев?
например, я вижу задачу, где дан объем аликвоты и общий объем. Как понять, где какую формулу использовать: я видела где-то отношение Vк/Va, а где-то наоборот применяют. Я вообще запуталась??? -
У меня не получается решать задачи, может есть какой-то гайд? Я решаю уже очень давно, но я не «вижу»решение, не понимаю, с чего вообще начинать, если вижу задачи на титрование…
-
В 06.01.2023 в 19:13, Furio Giunta сказал:
[nэ(NH4SCN)-nэ(AgNO3)]*Mэ(Ag)/0.6
(((20*0,2-20*0,1)/1000)*107,8)/0,6=0,359Спасибо спасибо спасибо!!!
-
Какую массу сплава, содержащего около 60% серебра,следует взять на анализ, чтобы после её растворения и добавления 20.0 мл 0,2 м NH4SCN на тирование избытка NH4SCN потребовалось 20,0 мл 0,1 м AgNO3? Ответ: 0,36г
я решала след образом:
сначала посчитала ню (избытка роданида: он численно равен ню Agno3)=20*0,1/1000=0,002моль
затем нашла ню nh4scn, который прореагировал с навеской=0,02*0,2/1000=0,004 моль
отсюда вычитаем тот избыток роданида, найденный ранее
ню (роданида по реакции)=ню(навески)=0,004-0,002=0,002 моль
из отношения m(Ag)/g(навеска)=0,6
g=m(Ag)/0,6
дальше не знаю, что делать ;(((
-
В 06.01.2023 в 18:22, Lеоnid сказал:
Это почему? Процентная концентрация не равна молярной.
Разница более трех порядков должна быть для раздельного титрования. При расчете рН вклад второй ступени незначителен.
А что тогда делать с процентной концентрацией? Насчет второй ступени поняла, спасибо

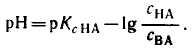
Реакция пойдет до гидроксида или сульфата циркония?
в Решение заданий
Опубликовано
Спасибо большое, да, написать реакцию в целом
Спасибо)