
бродяга_
-
Постов
13013 -
Зарегистрирован
-
Посещение
-
Победитель дней
326
Тип контента
Профили
Форумы
События
Сообщения, опубликованные бродяга_
-
-
-
4 часа назад, Paul_K сказал:
Только это окажется не алмаз, а кристалл меллитовой кислоты
включаем электролиз и получаем на аноде алмаз. одна проблема, он выходит опять нано размерный. размером с бочке не получается.

-
хлорная с хромовым ангидридом как то попадался такой рецепт.
у меня такая смесь грязных алмазов уже несколько лет залита хромовым ангидридом с аккумуляторным эл.,
вроде как графита не видно уже.
-
18 минут назад, yatcheh сказал:
как синильная кислота.
для солей в гальванике с драгметаллами вполне применима.
-
Только что, yatcheh сказал:
Лучше перманганатом.
домашнего применения акролеину не найдется, типа капустниц или других вредителей побаловать?
-
по ходу реакции образуется как примесь некоторое количество акролеина.
какие есть способы его нейтрализовать? возможно ли окислить перекисью водорода?
-
-
-
8 часов назад, Сергей85 сказал:
Или именно концентрат медного купороса убивает плесень -
всего лишь некоторые виды. не факт что медный купорос на все сто избавит от плесени.
-
3 минуты назад, mirs сказал:
, а потом вверх по Урупу.
в Краснодарском крае тоже есть река Уруп.

зачем калий не понял?
-
14 минуты назад, mirs сказал:
и долго варены..
в автоклаве делал 120 градусов давал. только грибов вот уже лет 20 нету. климат меняется. о том сколько в детстве собирал вспоминаю как сказку.
-
7 минут назад, aversun сказал:
Самое простое нагреть ее градусов до 400 и подержать, будет как из магазина.
по моим наблюдениям при 380 загорается углерод. так что 400 в самый раз.
-
3 минуты назад, WASQ сказал:
А можно ли это использовать для исследования природного газа на примесь воздуха в домашних условиях?
на химзаводе ( которого уже нет) был такой способ. так что возможно.
-


-
 1
1
-
 1
1
-
-
прошлой зимой ко мне крыска повадилась пробираться к раковине и кушала мыло, с большим аппетитом, предпочитая другие цивильные продукты.
-
3 минуты назад, Аль де Баран сказал:
И сопоставьте эту величину с цифрами из любой таблицы растворимости солей.
вот клоп тоже вроде маленький, если сравнивать с человеком. но проблему может создать серьезную.

-
49 минут назад, Аль де Баран сказал:
одновалентная медь сильно портит нервы гальваникам, она так же принимает участие в образовании дендритов...
https://studopedia.ru/19_331836_elektroliti-dlya-medneniya.html
...В кислом электролите медь (анод) растворяется с образованием в растворе двухвалентных ионов, которые восстанавливаются на катоде. Это видно из значений стандартных электродных потенциалов меди: Сu/Сu+ = -0,51 В; Сu/Сu2+ = +0,337 В; Сu+/Сu2+ = +0,15 В. Однако в растворе в присутствии металлической меди протекает реакция диспропорционирования
 ,
,
в результате которой в растворе появляется небольшое количество ионов одновалентной меди (около 10-3 моль/л). С повышением температуры и понижением кислотности электролита концентрация Сu+ увеличивается, и выпадает губчатая металлическая медь (реакция сдвигается влево), которая ухудшает качество осадка меди на катоде. При высокой кислотности не происходит накопления ионов Сu+, так как одновалентная медь окисляется кислородом воздуха:
 .
.
Наряду с этим с повышением содержания кислоты увеличивается электропроводность раствора и, следовательно, снижается напряжение на ванне. При недостатке кислоты возможен гидролиз соли одновалентной меди с образованием оксида Сu2О, который загрязняет электрохимический осадок:

Осадки меди имеют крупнокристаллическую структуру, но они плотные и компактные.
Распределение тока и металла по поверхности катода сложного профиля неравномерное, что является большим недостатком кислых электролитов...
-
а когда напругу в сети за час вырубают несколько раз ( комп включен напрямую бесперебойник, сдох давно)
насколько долго выдержит техника такое издевательство?
может вырубить и не рисковать?
-
При взаимодействии меди с аммиачным комплексом Cu(II) образуется бесцветный аммиачный комплекс одновалентной меди. В результате этого синяя окраска раствора исчезает:
[Cu(NH3)4](OH)2 + Cu = 2[Cu(NH3)2](OH)
Все подготовительные операции закончены. Теперь сам опыт. Поставьте колбу на белый фон, а рядом с ней - пустой стакан (или банку). Зрители наблюдают закрытую колбу с бесцветным раствором. Предложите всем желающим убедиться, что в стакане ничего нет. Теперь откройте колбу и медленно перелейте раствор в стакан. От контакта с воздухом бесцветная жидкость станет слегка синей. Если содержимое стакана перемешать или продуть через него воздух с помощью пипетки, окраска раствора будет усиливаться, пока раствор не станет интенсивно-синим. Впрочем, жидкость станет синей и без посторонней помощи, просто этот процесс будет длиться дольше, поскольку для диффузии кислорода в раствор нужно время.
Аммиачный комплекс одновалентной меди легко окисляется кислородом воздуха до синего аммиачного комплекса двухвалентной меди:
4[Cu(NH3)2](OH) + 2H2O + O2 + 8NH3 = 4[Cu(NH3)4](OH)2 -
1 час назад, Ruslan_Sharipov сказал:
до бесцветного сульфата меди-I.
бесцветный он будет без присутствия кислорода...
здесь есть об этом в середине страници...
-
39 минут назад, old squirrel сказал:
малаты
по разной степени замещения отсюда множественное число солей. -
катализаторы тоже могут запускать не желательные реакции...
-
-


 ,
,
 .
.
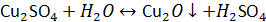


Веселые картинки
в Курилка
Опубликовано
https://i12.fotocdn.net/v1/152/anim_vid/307/2825466519.mp4