Student1231
Пользователи-
Постов
26 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Весь контент Student1231
-
1.CuSO4-голубоватый, zn so4-бесцветный, поэтому и цвет меняется, ну и осадок Cu-медь,темно-оранжевого цвет 2.CuO-осадок чёрного цвета 3.kmno4 - сильный окислитель, а его раствор фиолетового цвета. Здесь протикает ОВР, поэтому и цвет поменяется, так как и сера, марганец меняют с.о.
-
В первой реакции получится:продукт А это α-метил-α,α-дихлортолуол и побочный продукт это хлороксид фосфора
-
То есть ZnS будет существоват в виде ионов?
-
Оказывается имелось ввиду, что падает только CdS. А ZnS вступит взаимодействие с HNO3
-
Нет, это просто сайт с задачами. И там надо вбивать ответ. Но он выдаёт, что неправильно. Попробую в тех поддержку написать
-
Через 100 г раствора, содержащего нитраты цинка и кадмия в мольном соотношении 2:1, пропустили избыток сероводорода. В результате реакции выделилось 4,32 г осадка. Определите массовую долю нитрата цинка в исходном растворе. Составим УХР Zn(NO3)2+H2S=ZnS+2HNO3 Cd(NO3)2+H2S=CdS+2HNO3 По УХР n(Zn(NO3)2)=n(ZnS) обозначим за x n(Cd(NO3)2)=n(CdS) обозначим за y И получимсистему |97X+144y=4.32 |x:y=2 по условию X=0.0256 Mr(Zn(NO3)2)=0.0256*189=4.8384 Массовая доля=4.8384:100=0.04834 Или 4.83%. Но это неправильно. Почему?
-
В 500 г раствора, содержащего нитраты хрома(III) и марганца(II), добавили избыток сульфида натрия, при этом выпало 36,4 г осадка. Осадок отделили, промыли водой и залили избытком разбавленной соляной кислоты. Весь осадок растворился, и выделился газ объемом 6,72 л (н.у.). Определите массовую долю нитрата хрома в исходном растворе. Я не очень понимаю как решать. Для начала написал УХР. 2Cr(NO3)3 + 3Na2S + 3H2O = 2Cr(OH)3↓ + 3H2S↑ + 6NaNO3 Mn(NO3)2+Na2S=2NaNO3+MnS Cr(OH)3+3HCl=3H2O+CrCl3 MnS+2HCl=MnCl2+H2S Потом нашёл n(H2S)=6.72:22,4=0.3 Моль. Дальше по УХР n(H2S)=n(MnS)=Mn(NO3)2 Потом m(осадка) = 36.4-n(MnS)*Mr(MnS)=10.3 n(Cr(OH)3)=10.3:103=0.1 n(Cr(OH)3)=n(Cr(NO3)3)=0.1 Ну и наконец Массовая доля = (0.1*Mr(Cr(NO3)3))/500 Готово
-
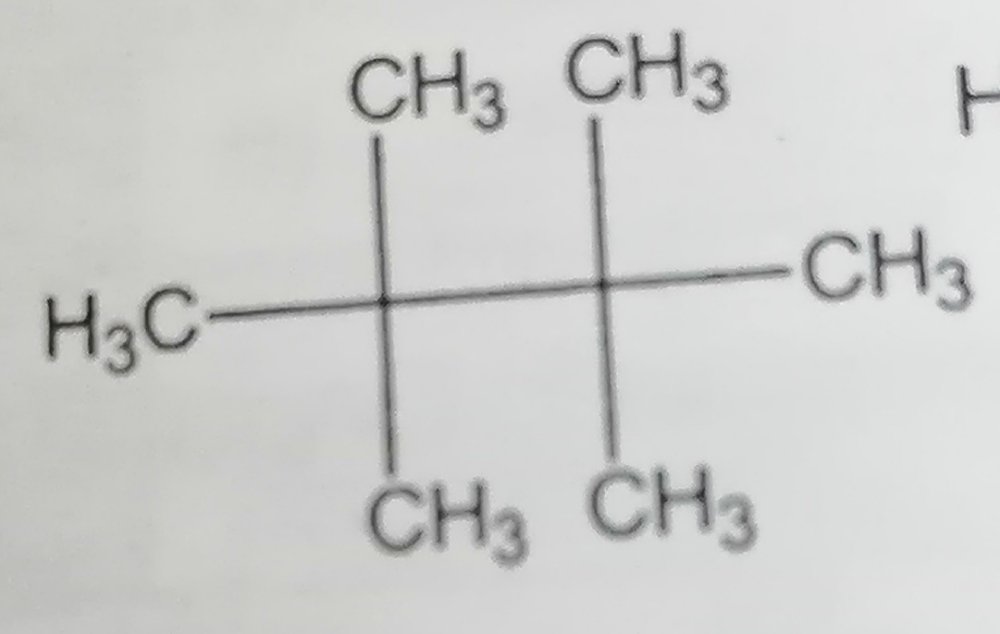
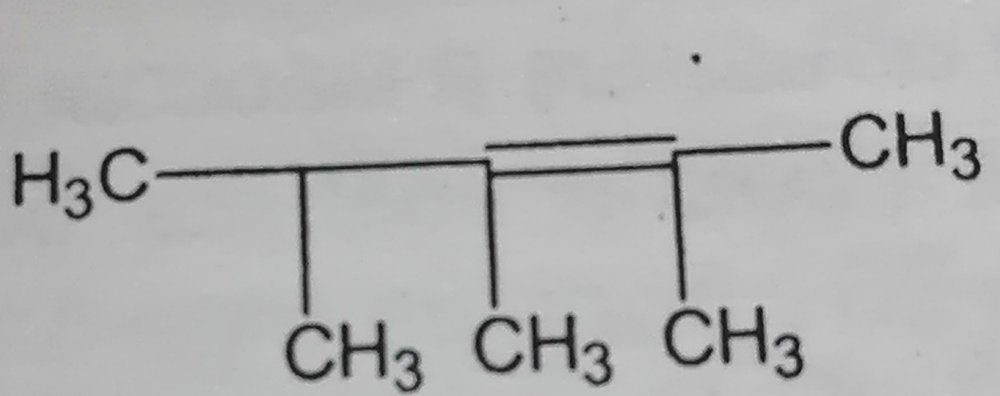
При гидролизе карбида магния Mg2C3 образуется газ пропин C3H4. При растворении в воде смеси карбидов алюминия и магния выделилось 13,44 л (н.у.) газа, и образовалось 66,0 г осадка. Определите массу исходной смеси. Я написал реакции Mg2C3+4H2O=C3H4+2Mg(oh)2 Al4C3+12H2O=3CH4+4Al(OH)3 и по ним составил уравнения Где x-моль Mg2C3 и y-Al4C3 Но ответ все равно неправильный. Объясните пожалуйста, где у меня ошибка в решение
-
Тоже спасибо. Просто впервые встретил подобную задачу и не знал к чему подцепиться!
-
Да, при вычисление небольшая ошибка. Спасибо большое за помощь. А-то вообще не понимал как решать. А теперь разобрался
-
К сожалению ответ не подходит. Пишет, что неправильно. Если что это я, просто другой акк.
-
Ааа, кажется понял, спасибо большое
-
А как это сделать, объясните пожалуйста
-
Проверьте правильность решения задачи Через `448` г раствора гидроксида калия с массовой долей щёлочи `10%` пропустили `17,92` л (н. у.) сернистого газа. Определите массовую долю соли в полученном растворе.
-
Да, проворачивался.
-
HCl- ковалентная-полярная(так между двумя неметалами) NaBr-ионная(между металлом и неметалллом) Al2S3-ионная О2-ковалентная-неполярная Fe и Mg - как я понимаю это сплав, поэтому металлическая На счёт последнего не уверен
- 1 ответ
-
- 1
-

-
Какие массы растворов хлороводорода с массовыми долями w1 = 12 % и w2 = 28 % нужно смешать для получения 480 г раствора с массовой долей 22 %? Объясните пожалуйста, как решать. Методом подбора получил 180 и 300. А как решить расчётами?
-
p.s. Забыл указать увеличение 630крат
-
На днях наблюдал микромир почки животного. И тут увидел микроорганизм, заснял, но не могу понять, что это. Если кто знает, подскажите пожалуйста.
-
Уже не надо, разобрался
-
-
Спасибо большое!А то запутался!
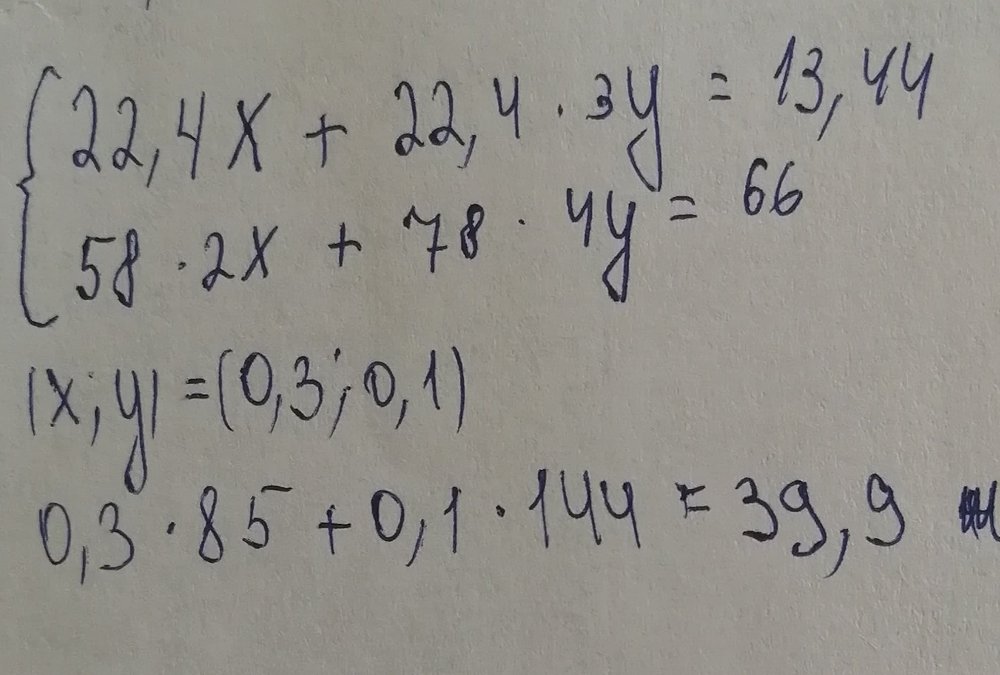
.thumb.jpg.802304eb3c73cc72d7b230714f8b1224.jpg)
.thumb.jpg.ae6af8ef9ac1daf488b401fce3f10666.jpg)