-
Постов
44 -
Зарегистрирован
-
Посещение
Весь контент Julia_Kiz
-
Произведение растворимости (ПР) - это произведение молярных концентраций ионов малорастворимого соединения, находящихся в растворе, с учётом их стехиометрии, которая отражается в виде показателей степени: ПР(PbI2) = [Pb2+]*[i-]2 В присутствии сильного электролита, который даёт при диссоциации ионы натрия и йода, считаем, что концентрация ионов йода обусловлена только присутствием NaI, так что [i-] = [NaI] = 0,001 моль/л. 7,2*10-9 = [Pb2+]*0,0012 Поскольку при диссоциации моля PbI2 образуется 1 моль ионов свинца, то концентрация этих ионов в растворе и есть растворимость данной соли: [Pb2+] = 7,2*10-9/0,0012 = 7,2*10-3(моль/л) Ответ: 7,2*10-3 моль/л
- 31 ответ
-
- 1
-

-
Не могу придумать ничего лучшего, чем использовать уравнение Аррениуса: lg(k2/k1) = (Ea/2,3R)*(1/T1 - 1/T2), где k1 и k2 - константы скоростей реакции при температурах Т1 и Т2 соответственно, Еа - энергия активации реакции, R - универсальная газовая константа. Сначала по имеющимся данным можно найти эту самую Еа: lg(2,7*10-4/1*10-6) = Еа/2,3*8,314*(1/273 - 1/313) 2,431 = Еа/19,1222*0,000468115 Еа = 99305 (Дж) А теперь, используя Еа, найти k3 - при 298 К: lg(2,7*10-4/k3) = 99305/19,1222*(1/298 - 1/313) lg(2,7*10-4/k3) = 0,835 (2,7*10-4/k3) = 100,835 = 6,840 k3 = 2,7*10-4/6,840 = 3,95*10-5 (с-1) P.S. Проверьте правильность рассчётов.
-
Для жесткой воды обычно различают временную (или карбонатную) и постоянную (или некарбонатную) жесткость. Первая обусловлена присутствием в воде Ca(HCO3)2 и Mg(HCO3)2. Временной жесткость называется потому, что при кипячении гидрокарбонаты разлагаются, и образующиеся карбонаты кальция и магния в значительном количестве выпадают в осадок: Ca(HCO3)2 ―t→ CaCO3↓ + CO2 + H2O Mg(HCO3)2 ―t→ CaCO3↓ + CO2 + H2O Постоянная жесткость обусловлена присутствием в воде сульфатов, хлоридов и некоторых других солей кальция и магния, которые не удаляются при кипячении. "Некоторые другие" в разных источниках могут быть разными, но в основном - это действительно сульфаты и хлориды SO42- и Cl-, так что пишите их.
-
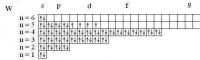
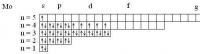
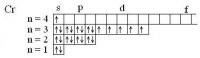
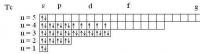
Спиновое квантовое число у электронов принимает только два значения: +1/2 и -1/2. У спаренных электронов спины "взаимно нейтрализуются": в сумме дают ноль. У каждого неспаренного электрона - спиновое число ms = +1/2. Так что Вам нужно найти элементы, в атомах которых а) 4 неспаренных электрона (1/2*4 = 2) б) 6 неспаренных электронов (1/2*6 = 3) г) 5 неспаренных электронов (5*1/2 = 5/2) а) Ru, W б) Mo, Cr в) Tc, Mn
-
1)Определить молярную концентрацию раствора карбамида,если при температуре 35o C давление паров над раствором оказалось на 2% ниже,чем над индивидуальной водой (p 1 =5,55 * 10-5 Па)? А что подразумевается под р1? Давление над раствором? И что, серьёзно 10-5 Па?... Вообще же формула такая Р1 = Р0*Хn, где Р1 - давление над раствором, Р0 - давление чистого растворителя (воды), Хn - мольная доля растворителя (воды). Так что, берёте заданное давление - я так и не знаю что это за давление: над водой или раствором - и рассчитываете другое давление (соответственно на 2% ниже или выше заданного). Подставите и рассчитаете мольную долю воды. Ну, допустим она у Вас получится 0,95. Это значит, что на 95 молей воды приходится 5 молей карбамида. Поскольку масса моля воды Н2О равна 18 г/моль, то В 95*18 = 1710 г воды содержится 5 молей карбамида. Можно пренебречь отличием плотности раствора от плотности чистой воды и принять, что 1710 г воды это 1710 мл воды. Значит, в 1000 мл или 1 л воды(раствора) содержится 5*1000/1710= 2,9 моля карбамида. Раствор имеет молярную концентрацию 2,9 моль/л. (в общем-то высоковато, так что мольная доля должна бы быть поменьше. Ну так я брала "от балды", просто для примера). 2)Раствор некоторого органического вещества в этиловом спирте закипает при температуре 78,41 С. Определить его молярную массу, если для приготовления раствора было взято 2г этого вещества, 48 г этилового спирта,темп.кипения которого 78,3 С, K=1,19 K*кг/моль? Формула следующая Δt = К*Cm, где Δt - повышение температуры кипения раствора по сравнению с чистым растворителем, К - эбуллиоскопическая константа растворителя, Cm - моляльная концентрация раствора, т.е. число молей вещества в килограмме растворителя. 78,41 - 78,3 = 1,19*Cm, Cm = 0,11/1,19 = 0,092 (моль/кг) Нам дано, что на 48 г спирта приходится 2 г вещества, значит, на килограмм спирта - 2*1000/48 = 41,67 г вещества. По рассчётам получилось, что 41,67 г неизвестного вещества составляют его количестве, равное 0,092 моля. Отсюда, один моль искомого вещества весит 41,67/0,092 = 452,9 г. Это и есть молярная масса. Ответ: примерно 453 г/моль.
-
Ну, можно посмотреть по термодинамическим параметрам. а) Al2O3 + 3H2 = 2Al + 3H2O б) SnO2 + 2H2 = Sn + 2H2O в) NiO + H2 + Ni + H2O Найти в справочнике значения энергий Гиббса веществ при стандартных условиях (Т = 298К) и посчитать величину изменения энергии Гиббса для реакции (из суммы ΔG подуктов вычитается сумма ΔG исходных веществ с учётом коэффициентов уравнения). Если ΔGреакции 0 - тогда нет. ΔG(Al2O3) = -1580 кДж/моль ΔG(Н2) = 0 кДж/моль ΔG(Al) = 0 кДж/моль ΔG(Н2О) = -237,2 кДж/моль ΔG(SnO2) = -418,4 кДж/моль ΔG(Sn) = 0 кДж/моль ΔG(NiO) = -211,7 кДж/моль ΔG(Ni) = 0 кДж/моль Итак, ΔGа = 2ΔG(Al) + 3ΔG(H2O) - ΔG(Al2O3) - 3ΔG(Н2) = 3(-237,2) - (-1580) = -711,6 + 1580 = 868,4 кДж ΔGб = ΔG(Sn) + 2ΔG(H2O) - ΔG(SnO2) - 2ΔG(Н2) = 2(-237,2) - (-418,4) = -474,4 + 418,4 = -56 кДж ΔGв = ΔG(Ni) + ΔG(H2O) - ΔG(NiO) - ΔG(Н2) = -237,2 - (-211,7) = -25,5 кДж Получается, что при температуре 298 К возможно восстановление оксидов никеля и олова.
-
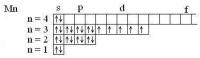
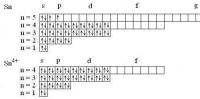
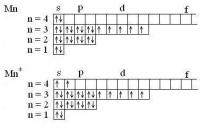
Электронные формула составляют так: сначала пишется номер энергетического уровня, потом форма орбитали (орбитальное квантовое число), а потом - в виде показателя степени - число электронов на данных орбиталах. Число электронов в атоме = номеру элемента в периодической системе. У олова (Sn) № 50, т.е. распределяем 50 электронов. Sn: 1s22s22p63s23p63d104s24p64d105s25p2 А чтобы "получить" положительный ион - нужно "выкинуть" столько внешних электронов, каков заряд иона. Т.е. для Sn4+ удаляем четыре электрона справа. Sn4+: 1s22s22p63s23p63d104s24p64d10 Для наглядности можно нарисовать электронографические формулы - там каждая орбиталь обозначается клеточкой, а электрон - в виде стрелки Для атома титана Ti: 1s22s22p63s23p63d24s2
-
1) Дана массовая доля раствора вещества %. Вычислить молярность, нормальность и титр раствора. Дано: 14% ; Эл-т NH4Cl Массовая доля показывает нам, сколько грамм растворенного вещества в 100 граммах раствора. Т.е. мы имеем 14 г NH4Cl в 100 граммах раствора. Для пересчётов нужна плотность раствора! Она должна быть дана... Если обозначить плотность 14%-ного раствора хлорида аммония через "р", то получим следующее. Молярность - это число молей растворенного вещества в литре раствора. Мольная масса хлорида аммония М(NH4Cl) = 53,5 г/моль. Значит 14 г этой соли - это 14/53,5 = 0,26 молей. 0,26 молей - в 100/р мл раствора Х молей - в 1000 мл раствора Х = 260*р/100 (моль/л) 2) Вычислить PH раствора слабого электролита. 1-я ступень диссоциации. Дано: Конц,М 0.01 ; Эл-т H2CO3 Н2СО3 H+ + HCO3- Кд1 = [H+]*[HCO3-]/[Н2СО3] = 4,5*10-7 Поскольку [H+]=[HCO3-], а концентрация недиссоциированных молекул кислоты можно принять примерно равной исходной концентрации раствора, то Кд1 = [H+]2/Ск-ты = 4,5*10-7 [H+] = корень квадратный из (Кд1*Ск-ты) = корень квадратный из (4,5*10-7*0,01) = 6,71*10-5 рН = -lg[H+] = 5 - lg 6,71 = 4,17. 3) Вычислить PH раствора сильного электролита, (или смеси сильных электролитов) Определить активность OH ионов в растворе. Дано: Конц,М 0.03 ; Эл-т NaOH Если нет специальных оговорок, то считаем, что диссоциация гидроксида натрия полная. Так как при диссоциации моля NaOН образуется 1 моль ионов ОН-, то концентрация гидроксид-ионов равна концентрации раствора щёлочи [OH-] = 0,03 моль/л = 3*10-2 рОН = 2 - lg3 = 1,52 рН и рОН связаны соотношением: рН = 14-рОН = 14-1,52 = 12,48. 4) Определите массу осадка и концентрацию иона металла в г/л в сливаемом растворе, если в 1 м3 его растворить m граммов сильного электролита Дано: Конц,М 0.002 ; Эл-т Ba(NO3)2 ; Масса,г 87 ; Эл-т K2SO4 Мольная масса K2SO4 равна 174 г/моль Поэтому 87 г сульфата калия - это 87/174 = 0,5 молей. А нитрата бария в кубометре его 0,002М раствора будет 2 моля. Ba(NO3)2 + K2SO4 = 2KNO3 + BaSO4 Из уравнения видим, что мольные соотношения реагентов 1:1, соотношение исходных веществ и осадка тоже 1:1, сульфат калия получается в недостатке, так что, осадка сульфата бария получится 0,5 молей. Расходуется 0,5 молей нитрата бария, остаётся его 2 - 0,5 = 1,5 моля. Мольная масса сульфата бария 233 г/моль, так что 0,5 моля его это 116,5 г. При диссоциации 1 моля нитрата бария образуется 1 моль ионов бария, поэтому в кубометре раствора будет 1,5 моля ионов бария - это 1,5*137 = 205,5 молей. В литре = 0,2055 молей. Ответ: масса осадка сульфата бария 116,5 г, концентрация ионов бария 0,206 моль/л. 5) Запишите уравнение процесса гидролиза соли и рассчитайте PH раствора, учитывая 1 степень гидролиза. Как изменяется PH при нагревании раствора и почему. Дано: Конц,М 0.05 ; Эл-т CrCl3 CrCl3 + H2O CrOHCl2 + HCl (молекулярная форма) Cr3+ + H2O CrOH2+ + H+ (ионно-молекулярная форма) Константа гидролиза: Кг = [CrOH+][H+]/[Cr3+] Если умножим и разделим числитель и знаменатель на [OH-], то получим: Кг = Kw/Кд3, где Kw - ионное произведение воды, 10-14; Кд3 - константа диссоциации основания (Cr(OH)3) по третьей ступени (равна 1*10-10) Кг = 10-14/10-10 = 10-4 [H+] = корень квадратный из (Кг*С) = корень квадратный из (10-4*0,05) = 2,24*10-3 рН = -lg [H+] = 3 - lg 2,24 = 2,65
-
Гидролизу подвергаются соли, образованные либо слабой кислотой и сильным основанием, либо слабым основанием и сильной кислотой, либо слабой кислотой и слабым основанием. Соли, образованные сильной кислотой и сильным основанием гидролизу не подвергаются. К солям последнего типа относится из перечисленных в условии только KCl - только эта соль не подвержена гидролизу. Al2(SO4)3 - соль слабого основания и сильной кислоты. Гидролиз солей такого типа идёт по катиону. Al3+ + H2O AlOH2+ + H+ (это ионномолекулярное уравнение) Al2(SO4)3 + 2H2O 2AlOHSO4 + H2SO4 (это молекулярное уравнение) В обычных условиях гидролиз ограничивается первой ступенью. Из ионного уравнения видно, что в растворе создается некоторый избыток ионов H+, значит раствор соли будет иметь кислую реакцию: рН < 7. K2S - соль сильного основания и слабой кислоты, гидролизуется по аниону: S2- + H2O HS- + OH- K2S + H2O KHS + КOH Гидролиз в обычных условиях тоже ограничен первой ступенью. В растворе накапливаются ионы ОН-, поэтому среда раствора щелочная и рН > 7. Pb(NO3)2 - соль слабого основания и сильной кислоты. Гидролиз идёт по катиону: Pb2+ + H2O PbOH+ + H+ Pb(NO3)2 + H2O PbOHNO3 + HNO3 Раствор имет кислую реакцию, рН < 7.
-
1. Титр - это количество грамм растворенного вещества в 1 мл раствора. Эквивалентная масса основания равна молярной массе, делённой на число гидроксогрупп, т.е. Мэ(Ва(ОН)2) = М(Ва(ОН)2)/2 = 171/2 = 85,5 г/моль. Значит, в 3 литрах раствора содержится 8,55 г Ва(ОН)2, ну а в 1 мл: Т = 8,55/3000 = 0,00285 (г/мл). Ответ: Т = 2,85х10-3 г/мл. 2. Вся "заковыка" в том, что, внося в раствор кристаллогидрат, мы увеличиваем количество растворителя, т.к в состав кристаллогидрата входит кристаллизационная вода. Количество кристаллогидрата неизвестно, значит, мы не знаем, сколько воды внисится с ним. Но если мы выразим концентрацию раствора относительно кристаллогидрата, то можем исключить влияние неизвестной величины. Итак, в состав 1 моля, или 322 г, кристаллогидрата Na2SO4x10H2O входит 142 г Na2SO4 и 180 г Н2О. 142 г Na2SO4 должны составлять 20% 322 г Na2SO4x10H2O будут составлять Х % Х = 45,35 %. Теперь найдём количество кристаллогидрата сульфата натрия, которое нужно растворить в 1800 г (100 молях) воды для получения раствора, содержащего 45,35 % кристаллогидрата и 54,65% воды, т.е. В 54,65 г воды нужно растворить 45,35 г кристаллогидрата В 1800 г воды нужно растворить Y г кристаллогидрата Y = 1493,69 г кристаллогидрата. Поскольку масса 1 моля кристаллогидрата 322 г, то вычисленная масса его составляет 1493,69/322 = 4,64 моля. Ответ: 4,64 моля.
-
Условия Ваших задач отсутствуют кроме той, которая "ещё одна". При взаимодействии MgO и соляной кислоты образуется соль - хлорид магния. Расчёт проводится по уравнению реакции, единственная "загвоздка": нужно оценить, какой из реагентов в избытке, какой - в недостатке. масса соли будет рассчитываться по тому веществу, которое в недостатке. Дано 500 мл 20%-ной соляной кислоты (1,1 г/мл). Значит, 500 мл - это 500х1,1 = 550 грамм раствора. Величина процентной концентрации показывает нам, сколько грамм растворенного вещества содержится в 100 граммах раствора. Т.е. у нас 20 грамм HCl в 100 граммах раствора, ну а в 550 граммах этого раствора, соответственно, 550х20/100 = 110 грамм HCl. Оксида магния дано 80 грамм. Уравнение реакции: 2HCl + MgO = MgCl2 + H2O Видим, что с 2 молями HCl реагирует 1 моль MgO. Масса моля HCl = 36,5 г/моль. Масса моля MgO = 40 г/моль. Значит, для реакции с 36,5х2 = 73 граммами HCl требуется 40 грамм MgO А для реакции с 110 граммами HCl - Х г MgO Х = 110х40/73 = 60,3 г - такой массы MgO достаточно для полного взаимодействия с массой кислоты, содержащейся в данном объёме раствора. А дано 80 грамм MgO. Значит, он в избытке. Считаем массу соли по кислоте. Из 2 молей кислоты образуется 1 моль хлорида магния. Масса двух молей соляной кислоты равна 73 г. Масса моля хлорида магния равна 95 г. Т.е. Из 73 г - 95 г Из 110 г - Y г Y = 143,2 г Ответ: 143,2 г MgCl2.
-
1. Алюминий пишется с одной "л"; 2. ВодороД будет "выделившИйся". 3. Нужно использовать уравнение Менделеева-Клапейрона, чтобы найти массу выделившегося водорода. pV = (m/M)RT, где p - давление, мм рт. ст.; V - объём газа, мл; m - масса газа, г; M - молярная масса газа; R - газовая постоянная, при использовании давления в мм рт.ст. числовое значение её 62360; Т - температура, К; Т.е. получаем: 755•274 = 62360•(m/2)•(273+19) Откуда m = 0,0227 (г) - столько водорода выделилось при взаимодействии с соляной кислотой указанной массы алюминия. А эквивалентная масса водорода равна 1 г/моль. Итак, по закону эквивалентов можно записать: 0,2046 г алюминия эквивалентны 0,0227 г водорода, Х г алюминия эквивалентны 1 г водорода Откуда Х = 9,01 (г) Это и есть эквивалентная масса алюминия. Ответ: Мэ(Al) = 9,01 г/моль.
-
С каких это пор "парочка" равна четырём? На нейтрализацию 0,943 г фосфористой кислоты израсходовано 1,291 г гидроксида калия. Вычислите эквивалент и молярную массу эквивалента фосфо-ристой кислоты, ее основность и напишите уравнение реакции нейтрализации. Тут возможны два варианта, поскольку фосфористая кислота двухосновна: KOH + H3PO3 = KH2PO3 + H2O или 2KOH + H3PO3 = K2HPO3 + 2H2O В первом случае с 1 молем кислоты реагирует 1 моль основания, а во втором - с 1 молем кислоты - два моля основания. Так что, найдите мольные соотношения ваших реагентов - и будем вам счастье! Масса моля KOH = 56 г/моль, масса моля Н3РО3 = 82 г/моль. Значит, 0,943 г кислоты - это 0,943/82 = 0,0115 моль кислоты, а 1,291 г основания - это 1,291/56 = 0,0231 моль основания. Т.е. видим, что соотношение кислота : основание = 1 : 2, значит, реализуется вариант 2KOH + H3PO3 = K2HPO3 + 2H2O и кислота проявляет себя как двухосновная. Эквивалент Э(Н3РО3) = Н3РО3; Мэ(Н3РО3) = М/2 = 82/2 = 41 г/моль. ------------------ При полном сгорании некоторого вещества массой 2,66 г получилось 1,54 г диоксида углерода и 4,48 г диоксида серы. Определите формулу вещества и вычислите его молярную массу. Из состава продуктов горения видим, что в состав исходного вещества входили углерод и сера (ну, может быть ещё кислород). В 44 г СО2 содержится 12 грамм углерода В 1,54 г СО2 содержится Х г углерода Х = 0,42 г. В 64 г SO2 содержится 32 г серы В 4,48 г SO2 содержится У г серы У = 2,24 г Суммируем: 0,42 + 2,24 = 2,66 г. Получена как раз масса исходного вещества, т.е. в состав входили только углерод и сера. СхSу - количественное соотношение элементов можно найти, разделив их массы на атомные массы элементов: т.е. х : у = 0,42/12 : 2,24/32 = 0,035 : 0,07 = 1 : 2 Т.е. это вещество - СS2 - сероуглерод. Его молярная масса 12 + 32х2 = 76 г/моль. ------------------ 5,10 г порошка частично окисленного магния обработали соляной кислотой. При этом выделилось 3,74 л газа (T = 26oC, P = 764 мм.рт.ст.). Какова массовая доля, %, магния в образце? Mg + 2HCl = MgCl2 + H2 Масса моля магния - 24 г/моль Объём моля водорода 22,4 литра. Т.е., поскольку из 1 моля магния, как видим по уравнению, получается 1 моль водорода, то Из 24 г магния - 22,4 литра водорода Из Х г магния - 3,74 л водорода Х = 4,01 г. Т.о., чистого магния в том порошке было только 4,01 г. Следовательно - 5,10 - 4,01 = 1,09 г - это уже окисленный магний. 4,01/5,10 = 0,786 или 78,6% - массовая доля магния. ------------------ Приведите полную и характеристическую формулы атомов в нормальном и возбужденном состояниях. Приведите графическую электронную формулу валентных подуровней элементов в нормальном и возбужденнном состояних, укажите возможные валентности. Приведите формулы гидридов и оксидов, соответствующие высшим степеням окисления этих элементов. Селен, марганец, фтор. Селен: 1s22s22p63s23p63d104s24p4 - это полная электронная формула; 4s24p4 - это характеристическая (если я правильно понимаю, что значит "характеристическая формула"...) Соответственно: Марганец: 1s22s22p63s23p63d54s2 и 3d54s2 Фтор: 1s22s22p5 и 2p5 Нормальные и возбужденные состояния (возбуждённые обозначаются звездочками): Валентные возможности: от двух до шести (в основном - чётные: 2, 4, 6). Валентные возможности: от 2 до 7. Валентные возможности: 1 (только степень окисления -1).
-
Начнём с того, что нам НАДО ПРИГОТОВИТЬ. 5 л 2%-ного расствора (пл. 1,02см3). Величина процентной концентрации показывает нам, сколько грамм растворенного вещества содержится в 100 граммах раствора. Т.е. в дданном случае 2 г карбоната натрия содержится в 100 граммах этого раствора. 100 грамм раствора с плотностью 1,02 - это 100/1,02 = 98,04 мл этого раствора. Т.е. получаем пропорцию В 98,04 мл раствора - 2 г карбоната натрия В 5000 мл раствора - Х г карбоната натрия. Х = 102 г. То есть, что мы узнали? - Что нам надо взять такой объём 10%-ного раствора карбоната натрия, в котором содержится 102 грамма карбоната натрия. А что мы знаем сейчас из того факта, что раствор у нас 10%-ный? - Что в 100 граммах его содержится 10 грамм карбоната натрия. Плотность этого раствора 1,105 г/мл, значит, 100 грамм его составляют объём 100/1,105 = 90,5 мл. Итак, в 90,5 мл раствора содержится 10 грамм карбоната натрия в У мл раствора содержится 102 грамма карбоната натрия У = 923,1 мл. Ответ: в 923,1 мл.
-
Ну, можно сказать, что вы как раз справились с самой сложной частью. А дальше - просто расчёт по уравнению реакции: HNO3 + NaOH = NaNO3 + H2O Видно, что 1 моль кислоты реагирует с 1 молем щелочи (поскольку коэффициенты в уравнении реакции перед формулами данных соединений равны единицам). Масса моля HNO3 равна 63 г/моль Масса моля NaOH равна 40 г/моль. Найдя титр, вы нашли массу NaOН в 1 мл раствора, ну а в 35 мл, которые пошли на реакцию, было, соответственно, 35х0,016 = 0,56 г NaOH. Итак, получается пропорция: 63 г кислоты реагируют с 40 г основания Х г кислоты реагируют с 0,56 г основания Х = 0,882 г Вот и всё! P.S. Эквивалентную массу оснований считать делением молярной массы не на число атомов металла, а на число ГИДРОКСОГРУПП, участвующих в реакции. А то, например, для Ва(ОН)2 у вас получится тоже Мэ = М/1... Это не верно. Мэ(Ва(ОН)2) = М/2. (Однако, тоже надо учитывать, что это в общем случае, а так нужно смотреть по конкретной реакции. Поэтому и написала: "...число гидроксогрупп, УЧАСТВУЮЩИХ В РЕАКЦИИ". Если в реакции получаются основные соли, то тогда эквивалентная масса основания равна молярной массе, делённой на число гидроксогрупп, заместившихся на кислотный остаток).
-
Согласно закону действующих масс, скорость хим реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометричсеким коэффициентам. Следовательно, для данного примера: v = kCACB Скорость в начальный момент времени: v = k•0,80•1,00 =0,80k По истечении 20 минут, концентрация вещества А стала равной 0,78 моль/л, т.е уменьшилась на 0,80 - 0,78 = 0,02 моль/л. Поскольку реагирующие вещества А и В связаны мольным соотношением 1:1, то концентрация В тоже снизится на 0,02 моль/л и станет равной 1,00-0,02 = 0,98 моль/л. v2 = k•0,78•0,98 = 0,76k (это скорость через 20 минут). Ну а средняя скорость за 20 минут... Э-э-э... Ну, наверное, раз размерность скорости моль/л за секунду (моль•с-1•л-1), то поскольку концентрация уменьшилась на 0,02 моль/л за 20 минут, т.е. за 20х60 = 1200 секунд, то средняя скорость за это время 0,02/1200 = 1,67х10-5 моль•с-1•л-1
-
А! Вот оно что - "задания первого тура - на дом"... Интересная процедура! А зачем тогда все эти олимпиады??? Те, кто не может решить задания сам, если предоставят чужие решения и пройдут, то что же они будут делать во втором туре? Странно всё это. Хотя, если честно, у меня тоже от всех этих олимпиад остались неприятные впечатления. Согласия уж точно никогда не спрашивали... Процедура "для галочки". Но что ж поделать? В жизни многое делается лишь потому, что "так надо"...
-
Всё зависит от честности организации мероприятия. А вообще интересно, откуда берутся вопросы с олимпиадными заданиями? Помнится, в моё школьное время такие задания на дом не давали, и ничего похожего на них - тоже.
-
malinasas, я решила вашу задачу и отправила вам в личный ящик. Ответьте, пожалуйста, получено ли письмо, а то там объём текста очень большой - мало ли что...
-
1. Запишите молекулярные формулы оксида, кислоты, (или основания), соли элемента 4А группы, напишите три уравнения реакции с их участием. Ну, возьмём самый первый элемент - углерод. Оксид: СО2 (оксид углерода IV) Кислота: Н2СО3 (угольная кислота) Соли угольной кислоты - карбонаты: СаСО3 - карбонат кальция. СО2 + ВаО = ВаСО3 H2CO3 + 2NaOH = Na2CO3 + 2H2O CaCO3 + 2HCl = CaCl2 + H2O + CO2 2. Приведите графическую формулу ортофосфата кальция. Надо изобразить дважды структурные формулы ортофосфорной кислоты, а потом заменить три пары атомов водорода на кальций (при этом один из атомов кальция окажется связан с двумя остатками ортофосфорной кислоты). Что-то типа вот такого: 3. Предложите метод получения соли, рассчитайте массу моль этого вещества. Соли получаются множеством способов: -по реакции нейтрализации (кислота + основание) -кислота с основным оксидом -кислота + соль -основание + кислотный оксид -соль + соль -щёлочь + соль... Ну, например, кислота плюс соль: HCl + AgNO3 = AgCl↓ + HNO3 Соль - нитрат серебра - выпадает в виде белого осадка. Молярная масса соединения численно равна сумме атомных масс всех атомов, входящих в его состав. В случае нитрата серебра - это один атом серебра, один атом азота и три атома кислорода: М(Ag(NO3)) = 108 + 14 + 3х16 = 170 г/моль.
-
Δt = i·Kэ·Cm, где Δt - повышение температуры кипения i - изотонический коэффициент Kэ - эбуллиоскопическая константа Cm - моляльная концентрация растворённого вещества. Определим Cm: у нас 1 г С4Н9СООН в 99 граммах воды, а моляльная концентрация - это число молей растворённого вещества в 1000 г растворителя. Масса моля С4Н9СООН = 102 г/моль Т.е. Cm = 1х1000/102х99 = 0,099 (моль/1000 г) Рассчитываем понижение температуры кипения без учёта диссоциации: Δt = Kэ·Cm = 0,52х0,099 = 0,0515 Сравнивая полученное значение с экспериментально определённым, вычислим изотонический коэффициент: i = Δt/Δt(вычисл.) = 0,0525/0,0515 = 1,02 Степень диссоциации (a) связана с изотоническим коэффициентом (i) выражением: a = (i - 1)/(n - 1). n = число ионов, на которые диссоциирует электролит. В данном случае - два. a = (1,02 - 1)/(2 - 1) = 0,02 Степень диссоциации 2%.
-
Белая аморфоная гидроокись бериллия малорастворима в воде. Растворённая часть диссоциирует по схеме: Ве(ОН)2 Be(OH)+ + OH- Be(OH)+ Be2+ + OH- Суммарно: Be(OH)2 Be2+ + 2OH- Стоит заметить, что гидроксид бериллия имеет амфотерный характер, хоть и с сильным преобладанием основных свойств. Тем не менее какая-то часть его будет диссоциировать по типу кислоты: т.е. Be(OH)2 можем записать как Н2ВеО2 и: Н2BeO2 H+ + HBeO2- HBeO2- H+ + BeO22- Суммарно: H2BeO2 2H+ + BeO22- NiOHCl NiOH+ + Cl- (практически нацело) Ну и в какой-то мере (в соответствии с величиной константы диссоциации по второй ступени) распадается NiOH+: NiOH+ Ni2+ + OH- NaH2PO4 Na+ + H2PO4- (практически нацело) И в незначительной степени (в соответствии с Кдисс. второй и третьей ступеней): H2PO4- H+ + HPO42- HPO42- H+ + PO43- H2SO4 H+ + HSO4- HSO4- H+ + SO42- Суммарно: H2SO4 2H+ + SO42-
-
NA2CO3 - соль сильного основания NaOH и слабой угольной кислоты H2CO3. При гидролизе солей такого типа говорят, что он идёт по аниону, поскольку образующийся NaOН снова распадается на ионы Na+ и ОН-, а вот Н2СО3 - слабодиссоциирующее соединение, будет связывать ионы СО32- исходной соли. СО32- + Н2О HCO3- + OH- (молекулярно-ионное уравнение) Na2CO3 + H2O NaHCO3 + NaOH (молекулярное уравнение). Вторая ступень: HCO3- + H2O H2CO3 + OH- (молекулярно-ионное уравнение). NaHCO3 + H2O H2O + CO2 + NaOH (молекулярное уравнение). Поскольку угольная кислота разлагается на воду и СО2, а газообразный СО2 удаляется из зоны реакции, то гидролиз, особенно при нагревании, может пройти до конца (то есть, по обеим ступеням). В растворе накапливаются ионы ОН-, т.е. среда щелочная. рН>7. ZnCl2 - соль слабого основания Zn(OH)2 и сильной кислоты HCl. Гидролиз идёт по катиону. Первая ступень: Zn2+ + H2O Zn(OH)+ + H+ (молекулярно-ионное уравнение), ZnCl2 + H2O Zn(OH)Cl + HCl (молекулярное уравнение). Вторая ступень: ZnOH+ + H2O Zn(OH)2 + H+ (молекулярно-ионное уравнение), ZnOHCl + H2O Zn(OH)2 + HCl (молекулярное уравнение). В обычных условиях гидролиз ограничивается первой ступенью. В растворе накапливаются ионы Н+, т.е. среда кислая, рН
-
MgCl2 - соль слабого основания Mg(OH)2 и сильной кислоты HCl. Гидролиз подобного типа солей идёт по катиону: Mg2+ + HOH Mg(OH)+ + H+ Это ионное уравнение первой стадии гидролиза. Молекулярный вид уравнения: MgCl2 + H2O Mg(OH)Cl + HCl Вторая стадия гидролиза: Mg(OH)+ + HOH Mg(OH)2 + H+ Mg(OH)Cl + H2O Mg(OH)2 + HCl По ионным уравнениям хорошо видно, что в растворе накапливаются ионы водорода, т.е. реакция среды кислая, рН < 7. Na2SO3 - соль сильного основания NaOH и слабой сернистой кислоты H2SO3 Гидролиз идёт по аниону. Первая ступень гидролиза: SO32- + H2O HSO3- + OH- Na2SO3 + H2O NaHSO3 + NaOH Вторая ступень: HSO3- + H2O H2SO3 + OH- NaHSO3 + H2O H2SO3 + NaOH (Можно H2SO3 расписать в виде H2O + SO2). В данном случае видно, что накапливаются гидроксид-ионы, т.е. среда щелочная, рН>7.