Поиск
Показаны результаты для тегов 'al'.
Найдено 9 результатов
-
Меркаптид натрия, раствор (RSNa)+Алюминий (Al). Что будет?
GARMON опубликовал тема в Неорганическая химия
Здравствуйте, господа. Недавно получил доступ до водного раствора меркаптида натрия (продукт отработки газовых заводов). Теперь имею сильное желание переработать его во вторичный продукт. Как считаете если растворить в нем алюминий какая реакция получится? Во время растворения активно выделяется водород, при этом интересно нарушаются ли связи натрия с серой и углеводородными радикалами |R|. Конечная цель у меня это избавиться от меркаптанов (тиолов). Если есть свежие мысли на этот счет прошу поделиться. Если есть конкретный план или технология по всему этому готов заплатить . Главное чтоб в рамках разумного конечно же. -
Пару цитат: Я так понял, что алюминий получали из хлорида алюминия? И весь вопрос дороговизны сего метода заключается в том, что натрий дороже алюминия? Ну да, там еще кое-что было в виде взрывов... Но это же решаемо. Хорошо. Допустим что этот процесс дороже получения алюминия электролизом. Но, для производства 1кг натрия расходуется 14кв, для алюминия 17кв. Из за того что натрий легче алюминия то это еще минус кв для реакционной среды(или я где ошибся?). Из хлора выделившегося мы получаем по формуле(думаю CO достать особой проблемы не сосотоит) Я так понимаю что хлора тут чу-чуть больше нужно будет, но и лишний натрий не помешает, т.к. хлорид кальция очень гигроскопичен, и я так понимаю часть уйдет на реакцию с водой? 1. почему так не делают? 2. Для этого нужен особо чистый натрий? 3. Если нет можно расплав морской соли(прим. черного моря?) электролизить и сразу пропускать с примесями в процесс образования хлорида алюминия и заодно пока натрий с калием в газообразной форме пускать в процесс? 4. Рентабельней все-таки натрий продавать, хоть и с примесями?
- 17 ответов
-
- алюмини
- хлорид алюминия
-
(и ещё 2 )
C тегом:
-
Если в водный раствор CuSO4 с солью положить что-то алюминиевое, алюминий покроется элементарным Cu. Если обрезать не облепленный Cu алюминий, кинуть его в колбу и залить серной кислотой в нужно пропорции, то получится ли SO2? Алюминий с серной к-той дает водород, медь с серной к-той дает SO2.. SO2 + 3H2 = 2H2O + H2S - будет ли происходить? Или для реакции SO2 с H2 нужны другие условия нежели плиточный нагрев?
-
У Некрасова написано, что алюминий может существовать при степенях окисления -1, 0 (с бипиридином, с этим все ясно). О соединениях -1 сказано только то, что они существуют. Подскажите где можно об этом подробно почитать.
-
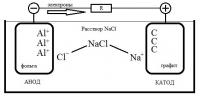
Заранее извиняюсь, я не химик по профессии, так что не будьте строги. Я тут заинтересовался самодельными батарейками. И занялся конструированием самой простой с солевым раствором в качестве электролита. Меня интересует какие химические продукты выделяющиеся в гальваническом элементе состоящим из соляного раствора NaCl•H2O и электродов из алюминия (фольга) и графита. Могу предположить следующее: 1.Натрий оседает на катоде (углероде, точнее графите) и не вступает с ним в реакцию. Хлор также оседает, но на аноде (алюминий, в моем случае фольга) и не вступает с ним в реакцию. 2. Либо... Далее натрий осевший на катоде реагирует с водой: 4Na + O2 +2H2O = 4NaOH И щелочь NaOH реагирует с алюминием (что мне кажется маловероятно): 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑ Или хлором, который осел на катод (что мне кажется более вероятным): 2NaOH + Cl2 = NaClO + NaCl + H2O А хлор, частично, вступает в реакцию с алюминием и в результате AlCl3 выпадает в осадок. И далее, AlCl3 реагирует со щелочью: AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Мой элемент длительное время способен выдавать напряжение в 0.3 вольта, но если периодически протирать графит, то напряжение возрастает примерно в двое, до 0.6 вольт, но очень скоро падает до 0.5. А через час, после протирания, падает до 0.3 вольт. Правда это все без нагрузки (если не считать сопротивление старенького вольтметра). При том, что если протирать фольгу, то особого подъема напряжения я не заметил. Далее, я заметил, что можно и не протирать катод, а сделать два катода соединенного одним проводом.При этом в то время как первый катод находится в растворе, второй сушится на воздухе. Когда напряжение падает до 0.3 то, если их поменять местами, вижу, что напряжение возрастает до 0.5, но в течении пары минут падает до 0.4. И если каждый раз так менять катоды с периодом в семь минут, то напряжение меньше 0.35 вольт не упадет. Я так подумал, а что если катодов будет не два а пять, к примеру, то время смены можно уменьшить, а среднее напряжение возрастет. Про это я сумел найти только то, что при прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. С тем же эффектом можно второй катод и не вынимать из раствора, а лишь провод коннектить то с одним, то с другим катодом... То есть если сделать некий электронный прерыватель работающий на той же батарейке которую он и регулирует, который переключатся между катодами, то напряжение можно усреднить и до 0.5 вольт. Я не физик, и не так хорошо знаком с электроникой, но мне кажется это очень интересным Итак, мои вопросы: 1. Почему так происходит с двумя катодами? 2. Какие все же реакции протекают в таком элементе?
-
Как можно разделить Ga, Be и Al? И как можно разделить из соединения ?
- 4 ответа
-
- Al
- Разделение
-
(и ещё 2 )
C тегом:
-
Приветствую всех. Давно задался таким вопросом. Как мы знаем, алюминий легко соединяется с кислородом при комнатной температуре, при этом на поверхности алюминия образуется оксидная пленка (Al2O3), которая и защищает металл от дальнейшего окисления. Хоть пленка и очень тонкая (~10^-5 мм), она очень прочная. Один из способов удаления с поверхности алюминия оксидной пленки это соединения ртути (амальгамы и прочее). В чем соль этого взаимодействия? Почему именно ртуть?
-
Помогите, пожалуйста, разобраться с гидролизом солей. Необходимо решить несколько примеров, ПОДРОБНО: 1. ZnBr2 + HOH 2. Na3PO4 + HOH 3. Al + HOH 4. KCl + HOH 5. SnCl2 + HOH 6. K2CO3 + HOH 7. ZnS + HOH Можно решить всего первые три, но лучше всего все семь. Помогите, пожалуйста...
- 5 ответов
-
- Гидролиз солей
- ZnS
- (и ещё 6 )
-
Здравствуйте, срочно нужна помошь. Стальная конструкция скреплена(соеденена) алюминиевыми "заклепками" . Написать уравнение процесов анода и катода, а так же схему гальванического элемента. Пишу с Латвии, поэтому перевожу с латышского, попытался как можно точнее. Все облазил, не могу найти ничего по этому заданию