-
Постов
436 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные ТоптуновПотапов
-
-
ТоптуновПотапов, спасибо за ответ! ...
Применительно к различным технологическим процессам материал диафрагмы различен. При электролизе NaCL нас интересует, в первую очередь, стойкость к хлору и щёлочи. В промышленности и лаборатории процесс ведут неделями, месяцами и даже годами безостановочно. За это время требуется сохранность диафрагмы и её работоспособность. Разобрать промышленный электролизер процесс трудоемкий и вредный. Требуется промывка, монтажно-демонтажные работы, сборка, проверка герметичности, пусковые работы и т.п.
С лабораторным электролизером легче - он разбирается и собирается проще и быстрее. С кустарным электролизером еще проще. От него не требуется ни технологичность, ни гарантированная герметичность и вообще требования зачастую отсутствуют вовсе.
Получая продукт электролиза на таком электролизере вы всегда загрязняете целевой продукт продуктами распада диафрагмы. Особенно если она из газетной бумаги

В электролизере всегда есть проникновение продуктов электролиза в смежные ячейки. Хлор проникает в коллектор водорода, водород в свою очередь проникает в коллектор хлора. Ионный обмен имеет место. С этим ничего не поделаешь. Выбор диафрагмы лишь дает оптимальное соотношение между этими процессами. Хотите диафрагму из бумаги? - нет проблем. Просто не сможете вести процесс длительное время безостановочно. Она или распадется от воды или растворится от щелочи. Это вопрос вашего терпения при замене. Есть возможность менять дважды в день? - смело начинайте процесс. Потом вы сами определитесь, хватает вам этого или лучше поставить другую - необслуживаемую но заведомо хуже.
Отвечая на Ваши вопросы:
Должна ли диафрагма быть абсолютной преградой? - нет, это из области фантастики. На практике много других проблем. Например куда девать тепло при электролизе.
Не будет ли образовавшийся водород проникать сквозь эту мембрану? - водород склонен образовывать молекулу Н2 и сразу выделятся из раствора. Проблема ничтожна.
Почему не использовать тупо газету намотанную в эмпирически подобранное кол-во слоев? - нестойкость к щелочи и хлору. Помимо этого будет образовыватся гипохлорит натрия, который быстро окисляет целлюлозу. Получаем щелоч загрязненную карбонатами и рядом прудуктов органического происхождения.
-
Определеить пригодность материала не сложно. Характеристик всего две-три
1. Протекаемость. Способность к физическому прохождению электролита сквозь материал по действием перепада давлений. Протекаемость диафрагмы должна быть оптимальной. Тоесть не слишком маленькой и не слишком большой. При слишком большой будет происходить смешение и проникновение электролита. При слишком маленькой будет повышенное сопротивление электрическому току, что требует более высоких напряжений и заметно замедляет процесс электролиза.(ток падает)
2. механическая прочность. Понятно без лишних слов
3. устойчивость к среде. Ну, грубо говоря, сколько времени диафрагма может считатся условно рабочей. Например целлюлоза в щелочной среде набухает и снижается протекаемость, затем разрушается. В кислой просто разрушается.
Отвечая строго на вопрос" где граница" - нету таковой. Это вопрос компромисса между потерями. Тока или электролита или продукта электросинтеза.
Оптимальная протекаемость у мелкопористой керамики при незначительном перепаде давлений. (нулевое)
-
Мне давно известна экзотермическая реакция CaO+H2O→Ca(OH)2
А какую температуру можно достичь с её помощью?
Это относительно не сложно. Для этого нужно знать теплоту реакции, теплоемкость компонентов и зависимость теплоты реакции от температуры если достижимая температура достаточно велика.
Итак:
Из справочника Равделя мы узнаем, что теплота образования Сa(OH)2 = - 985 кДж/моль, а теплоемкость = 87,49 Дж/моль*К. Так как достижимая температура достаточно велика, хорошо бы учесть зависимость теплоемкости от температуры. А также и зависимость теплового эффекта...
Дополнительная необходимая информация
СaO = - 635 кДж/моль
Н2О = - 286 кДж/моль
Теплота реакции = -985 - (-635+(-286)) = -64 кДж/моль
Расчитаем достижимую температуру в первом приближении: T = 64000/87.5 = 740 К (467 C)
Если вы хотите знать точнее, то без уравнений зависимости не обойтись.
Cр = 105,2 + 0,012*Т -19*10^5/Т^2
Подставляем в уравнение температуру найденную ранее (741 К) и находим теплоемкость при конечной температуре. Ср = 110 Дж/моль*к
Видно, что теплоемкость существенно меняется и это обязательно надо учесть. Надо либо брать интеграл, либо решать последовательными итерациями.
Интеграл очень громоздкий, но позволяет решить задачу в 1 действие .
Попробуем итерациями.
1. Усредняем теплоемкость в данном интервале температур и находим уточненную температуру.
Сp = (87.5+110)/2 = 99,1 Дж/моль*к
Достижимая температура: Т = 64000/99,1 = 645 К
2. Находим теплоемкость при 645 = Cр = 108.67
Усредняем теплоемпоксть Cp2 = (87.5+108.67)/2 = 98.1
Достижимая температура T = 64000/98.1 = 652
3 Находим теплоемкость при 652 = Cp3 = 108.85
Усредняем теплоемкость Cp3 = (87.5+108.85)/2 = 98.18
Достижимая температура Т = 64000/98.18 = 651,8 К
Для оценки температуры достаточно. Надо бы еще и зависимость теплового эффекта от температуры вычислить и сопоставить с достижимой температурой. Оставляю эту гимнастику топикстартеру, я уже размялся

в качестве подсказки:

-
 1
1
-
-
Да господи , хлорат натрия + аммиачка . Ничего трудного
а разделить как?
-
-
Хорошо себя ведут промышленные медно-графитовые щетки для коллекторных даигателей, долго не снашиваются.
Только их применение ограничено электролизом непонятно чего, так как присутствует порошковая медь в электроде. Для Двигателя щетки хорошие, для электролиза никчемные электроды.
Искать надо только графитовые, без всяких присадок. Например сварочные графитовые электроды или для воздушно-дуговой резки. Стоят доллар / ведро.
Например такие, марки ПК.

-
Углекислота при нормальном атмосферном давлении становится жидкой при - 78 градусах. При комнатной температуре она сжижается под давлением 62 кгс/см^2.
Никакие "соски" и "бутылки от колы" с такими давлениями и температурами не работают.
Ничего наподобии "жидкого азота" углекислота не дает. Она всегда превращается в твердую углекислоту. (жидкая она только под давлением) Её можно покупать на хладокомбинате килограммами. Называется сухой лёд. (бывает, также, в палатках с мороженным)
-
Продолжение поста # 36
Собственно способ выделения хлората натрия.
Насыщеный раствор хлорида натрия при 20 С содержит 26.34 % масс соли. Растворимость составляет 35,8 г /100 г воды) при 20 С Плотность насыщенного раствора при 20С 1,201 г/см^3
Чтобы можно было оперировать данными в более широком интервале температур, приведу данные от 0 до 100 С
в 1 литре насыщенного раствора при 20С содержится 316 г хлорида натрия.
В процессе электролиза содержание хлорида падает, а хлората растет, пропорционально количеству прошедшего электричества. На электролиз расходуется 9 фарадей электричества, 3 из которых идут на выделение кислорода. Остальные 6 идут на образование хлорат-иона
6ClO- + 6OH- + 6e → 2ClO3- + 4Cl- + 3H2O + 1,5O2.
Как видно из уравнения, только 66.6% прошедшего электричества идет на образование хлората. НО! в процесс электролиза генерируется атомарный хлор, который реагирует с водой с образование хлорноватистой кислоты - HClO, которая реагирует по уравнениям:
2HClO + ClO- → ClO3- + 2Cl- + 2H+
HClO + 2ClO- → ClO3- + 2Cl- + H+
В итоге выход по току возрастает и составляет более 66% достигая величины 80-90 % в зависимости от условий электролиза и материала анодов.
Образованию хлората по химическому механизму споособствует высокая температура ( 60 град и выше) и малая обьемная плотность тока Чем меньше тем лучше, обычно менее 10А/литр. Для этого делают отдельный "дозреватель" большого обьема, В него попадает раствор проходя через реактор - эхлектролизную ячейку, либо сама ячейка имеет значительный обьем. И оптимальные величины плотности тока на аноде (500-3000 А/м^2).
Встает вопрос, когда же концентрация хлорида достигнет 100 г / литр. ?
1. Расчитать с некоторой долей погрешности можно из уравнения выражающего количество часов требуемое для превращения заданного ( Х грамм) количества хлорида в хлорат при заданном выходе по току.
X - масса превратившегося хлорида.
I - средний ток за время процесса
кпд - выход по току (задаемся) величина около 80%
2. В электролизную ванну дополнительно поместить 1/20 от взятой массы хлорида и засеч время за которое эта масса хлорида растворится (перемешивание обязательно!). Так можно оценить напрямую скорость расхода хлорида и скорость процесса.
Пример: При электролизе током I ампер дополнительная масса хлорида массой X грамм растворилась за N часов.
Следует иметь ввиду, что выход по току падает при снижении концентрации хлорида в растворе и становиться меньше примерно на 5-7 % при концентрации хлорида на уровне 100 г/литр (конец процесса) Поэтому для оценки выхода по току надо взять среднюю(среднеинтегральную) величину между началом и концом процесса. Если в начале было, к примеру, 75 то к концу будет 70. Средняя величина будет на уровне 73% для рассмотренного примера.
После определения кпд своего электролизера можно повторно его не измерять, а расчитывать по первому выражению.
В конце процесса после того как израсходуется 200 г хлорида, образуется 365 г хлората натрия. Извлеч из раствора весь хлорат не представляется возможным ввиду его значительной растворимости. Мало того, извлеч из раствора можно лишь незначительную его часть при вымораживании. Поэтому раствор, после очистки от взвесей, подогревают и донасыщают хлоридом натрия. Растворимость в присутствии хлората, как уже стало ясно, меньше чем в чистой воде. При охлаждении содержание хлората уменьшается вследствии уменьшения растворимости. Растовримость хлорида тоже падает при снижении температуры раствора, но одновременно с этим увеличивается из-за снижения концентрации хлората натрия, который выкристаллизовывается. Это конкурирующие процессы, из которых сильнее проявляется увеличение растворимости хлорида в результате снижения концентрации хлората. Таким образом, раствор при охлаждении остается пересыщенным по хлорату натрия и ненасыщенным по хлориду. В процессе вымораживания выкристаллизовывается 30-40 % всего хлората.
"Возможно это не очевидно и труднО для понимания неподготовленному в плане физико-химических закономерностей происходящих в растворах. Кто-то, возможно, не может разобраться в этих тонкостях, тогда пусть примет на веру. За методику отвечаю. Если кого-то это успокоит, то это один из промышленных вариантов получения хлората натрия."
Итог: получаем кристаллическую фазу состоящую полностью из хлората натрия. Дополнительная очистка не нужна. Содержание продукта 99,5-99,8 %. Если есть желание можно перекристаллизовать при медленном охлаждении.
Маточный раствор (остаток после кристаллизации) донасыщаем хлоридом натрия снова и направляем на электролиз. При таком использовании маточного раствора содержание хлората натрия в конце электролиза станет в районе 500-550 г/л, хлорида 100-120г. Это уже считается оборотный раствор, а не первичный как при запуске ванны. Содержание хлорида в начале электролиза будет в районе 200 г/л и хлората 300-340г (хлорид больше не растворяется) и в повторном выделении хлората будет выделенно больше, по сравнению с раствором полученном из свежеприготовленного раствора хлорида натрия.
Надеюсь кому-то будет полезно.
P.S. При электролизе раствор постепенно приобретает щелочную реакцию и выход по току быстро падает. Зависимость выглядит так:
-
Ну при таком напряжении медь получается губчатой , хоть и растет быстро . qerik повторял подобное при токе до 30 мА , соответственно , при резисторе на 12 Ком
чтобы через резистор в 12кОм протекал ток в 30 мА надо напряжение U = I*R = 0.03*12000 = 360 вольт. Скажу прямо - при таких напряжениях электролиз не ведут. Это нонсенс.
Не хочу показатся грубым, но без указания площади электрода ваши миллиамперы никому ничего не говорят. Губчатая медь получается при высоких плотностях тока. Ну грубо говоря если вы даете ток 1 А/см^2 то конечно медь будет губчатой. Но если вы даете ток в 1А/дм^2 то поверхность будет гладкой. А если еще и электролит перемешиваете ...
повторяю при электролизе всё разнообразие эффектов зависит от плотности тока на электродах. Напряжение нужно только для того, чтобы процесс электролиза стал возможным. Ни о каких сотнях вольт на ванне речи не может быть.
-
мой пост в части " так получается из-за того, то раствор поваренной соли..." следует читать - "так получается из-за того, что раствор электролита, поваренной соли в частности, обладает....."
К раствору медного купороса это тоже относится. Ставить дополнительные внешние сопротивления нет необходимости, кроме случаев когда в методике прямо оговорена необходимость поддержания конкретного напряжения.
-
Если есть источник с фиксированным напряжением, то ток в цепи регулируется изменением расстояния между электродами. Близко стоят = большой ток, далеко стоят = ток маленький. Так получается из-за того, что раствор поваренной соли обладает заметным сопротивлением. Увеличивая длинну проводника (расстояние между электродами) вы увеличиваете сопротивление цепи. Ток автоматически падает.
Какое напряжение на ячейке не очень существенно, лишь бы оно небыло чрезмерно велико или чрезмерно мало. В интервале 3,5-20 вольт.
Отвечая на Ваш вопрос: Нужно учесть сопротивление электролита между электродами. А так как заранее его точно предсказать нельзя, то и дополнительное сопротивление расчитать нельзя. Ориентируйтесь на способ описанный выше.
Но если, все-таки, вам очень нужно то ориентировочно можно прикинуть.
Ограничение сверху:
U = 5.6. I = 0.025.
R = U/I = 5.6 / 0.025 = 224 Ом
Ограничение снизу = 0, так как возможен вариант, что расстояние между электродами очень велико и тока в цепи нет. Тогда требуемое сопротивление = 0
-
Позволю себе ответить на некоторые вопросы топикстартера.
Интересует непрерывный процесс:
Поскольку при электролизе раствора хлорида калия ничего, кроме солей хлорсодержащих кислородных кислот не получится, то интересует возможность непрерывного электролиза раствора, с периодическим отключением и охлаждением, для выгребания малорастворимой бертолетки с дна ванны, нужно будет только досыпать хлорид калия периодически.
Проблема в том, что перхлорат калия очень плохо растворим в воде. При 50 С это всего 51,5 грамм/литр. При 20 С = 16,7. Тоесть с литра раствора можно снять не более 30-33 грамм. А еще нужно учесть, что в растворе присутствует КСl, который высаливает перхлорат. В итоге получаете фантастические обьемы воды и мизерные количества получаемого перхлората. Граммов 10 с литра раствора.
Тут на сцену выходит перхлорат натрия. С литра вы получаете 200-300 грамм. Затем по обменной реакции получаете хоть ПХК хоть ПХА, схема одинаковая.
Теперь, по порядку:
1. Это вообще возможно? Не будет ли раствор при температуре 50-60 град загрязняться гипохлоритами и хлоритами так, что нужно будет кипятить раствор?
Получение прехлоратов всегда разбито на стадии. На первой стадии получают хлорат с простыми графитовыми электродами. А на второй применяют дорогие электроды - платина, ОРТА, двуокись свинца на графите и т.п. Это оправданно и технологически и экономически.
В одну стадию не получают - продукт получается слишком грязным. Вам нужен в бертолетке KClO2?. Вспышка неизбежна при смешении с органическими веществами.
2. Читал в интернете, что для графитового анода для увеличения выхода нужен дихромат, а для анода из соединений марганца или свинца - фториды. Так ли это, или дихромат даст с любым анодом хорошие результаты?
В электролизере только АНОД делается специально, катодом служит лист железа или железная сетка. Чтобы она не окислялась в воду добавляют хроматы - они оседают на железном катоде и защищают от электрохимического действия. Если катод делать из нержавейки то пляски с дихроматами не нужны. Мало того, дихроматы несколько ухудшают параметры PbO2 электрода. Хотя в целом % выхода растет. Эффект на уровне 2-3% (дли промышленности это много, для лаборатории можно принебреч)
3. Какова оптимальна плотность тока? И правда ли, что нужно ограничивать ток на единицу обьема раствора? Думаю рассчитывать все под ток около 150-250А.
Оптимально 1-3 КА/м^2 (10-30 А/дм^2) Анодная плотность. Катодная в два-три раза ниже - из экономических соображений чтобы не увеличивать расход материалов.
4. Каково оптимальное напряжение? Естественно, нужно минимизовать потери электричества, но чтобы все было нормально. 5-6В как пишут - это ок? Может взять поменьше? Нагрев раствора будет осуществляться отдельным нагревателем и термопарой для стабилизирования температуры.
Оптимально 4-6 вольт. Больше - слишком большой нагрев электролита (сложно охлаждать), Меньше - нужны хорошие соединения элетрических контактов и большое сечение проводящих шин.
Раствор вообще греть не надо, его надо охлаждать. Хотя реакция получения перхлората эндотермичная, тепло выделяется в ячейке по закону Джоуля-Ленца и намного превышает поглощение теплоты от самой реакции. Надо, скорее, охлаждать. Мало того, радиатор для охлаждения надо обязательно предусмотреть. Или хотябы в самом реакторе патрубки для его подключения должны быть. Можно подобрать режим, при котором тепло отводится через стенку в воздух... Но это шаманство, лучше предусмотреть теплообменник.
5. Устойчиво ли оргстекло в таких условиях (корпус ванны, полиметилметакрилат)?
Температура в 50-60 градусов выбрана как оптимальная для промышленных аппаратов. Так как тепло там отводится через теплообменник. Площадь теплообменника тем меньше, чем больше разность температур между горячим и холодным теплоносителем. А значит он дешевле. Но с другой стороны, слишком высокая температура подвергает все части электролизера интенсивному износу, а значит требуется более часта замена. Тех же электродов, которые не дешевы. Поэтому такая температура - компромисс между капитальными и текущими расходами.
На самом деле выход продукта практически одинаков во всем интервале рабочих температур (5-70С)
Оргстекло до 40-50 градусов держит нормально. Рабочий раствор без дихроматов тоже. С дихроматами на стекле появляется ничем не отмываемый налет. Если реактор не очень большой или он круглой формы. При бОльшей температуре оргстекло может деформироватся. Сам реактор можно сделать из обычного силикатного стекла (типа аквариума - клеить силиконовым герметиком) или 5-7 литровой бутылки питьевой воды или, что лучше всего, - взять бочку из полипропилена обьемом 5-10 литров и использовать в качестве реактора (дозреватель из другой бочки на 50-100 литров)
И главное:
Что еще, кроме известных платины, оксида свинца и оксида марганца будет устойчиво в качестве анода в таких условиях? Может, тантал, титан (он устойчив в царской водке), вольфрам или еще что из малораспространенных металлов?
Спасибо заранее за подсказки.
Многолетние исследования говорят, что при использовании графита в качестве анода получается наиболее дешевый продукт. Но есть всякие но. Например раствор надо периодически очищать от графитового шлама. Графит, из-за реакции с атомарным кислородом в момент выделения "горит" и электроды надо периодически менять. (точнее говоря они придвигаются навстречу друг другу в случае графита.) Ну и есть ограничения по температуре - выше 40 не греть, так как графит интенсивно разрушается, высокие плотности тока не давать. Держат на минимуме 500-1000А/м^2 (Да, вот тут и вылазит проблема с охлаждением, при разности температур в 15 градусов теплообменники получаются монстрообразные)
С точки зрения простоты обслуживания платиновые аноды вне конкуренции. Потом идут аноды ОРТА, потом графитовые. Магнетит, кокс и т.п. не рассматриваем - это от безысходности.
В дополнение могу сказать следующее:
Помимо рассмотренных проблем и вариантов их решения существует еще несколько. А именно:
1. Глубина переработки исходного NaCl в NaClO3 никогда не достигает 100%. Просто потому, что выход по току сильно падает при концентрации хлорида ниже 100 г/литр (напомню, что растворимость NaCl в воде 350 грамм/литр). Там сложный химизм реакции, расписывать нет смысла. Просто примите за факт: ниже 75-100 грамм/литр концентрацию NaCl не доводить. Тогда выход составит 75-80%
При этом получается раствор содержащий 500-600 г/л хлората и 90-120 г/л хлорида. Этот раствор надо разделить. Об этом в следующем посте.
Продолжение следует.
-
Ну так подождать подольше . По закону Фарадея ток и время - прямопропорциональные величины
Тут несколько иные проблемы. Если в двух словах, то дело не во времени, а в плотности тока и его распределении по длине электрода:
Для протекания электролиза с получением из хлората перхлората требуется определенная плотность тока на аноде. Порядка 1-3 КА/м^2. Иначе падает выход и / или получаются другие продукты реакции. Имея неопределенную площадь электрода вы не можете контролировать процесс, так как банально не можете установить нужный ток. Скорее всего он будет существенно занижен, т.к. площадь электрода при мелких частицах электродного вещества будет в разы (а может десятки раз) больше видимой (мнимой) площади электрода. В итоге вместо 1 КА/м^2 получаем 0,05. и массу иных проблем - в частности выделение газа внутри пористого электрода.
Можно пытатся компенсировать повышением тока через ячейку, но, ввиду высокого сопротивления такого "чулочного" электрода, это приведет к большим потерям в самом электроде и неравномерном распределении тока по высоте (длинне) электрода. Те части, которые находятся ближе к месту контакта будут работать с бОльшими плотностями тока, чем те которые расположены дальше. Закон ома, понимаеш.
Короче, проблем, связанных с "чулочным" электродом возникает больше, чем проблем связанных с изготовлением плотного осадка двуокиси свинца на графитовом электроде. Такие электроды надо изготавливать либо вращая электрод с большой скоростью (600 об/м), либо при очень хорошем перемешивании электролита. Я получал довольно качественные электроды в азотнокислом электролите с медным катодом.
Я выступаю ЗА проведение такого опыта. Это даст бесценную информацию о том, работает такой электрод или нет. Если есть возможность - сделайте. У меня, временно, нет.
-
Пытался осадить свинец на углеткань, что-то не держится он.
Дендриды лезут и сыплятся
Может режим не тот ?
Графит и углеткань не одно и тоже. По факту - углерод, но состояние поверхности и свойства категорически разные. Отсюда провал эксперимента по осаждению.
А если взять оксид свинца , натромбовать его в чулок плотно и использовать в качестве электрода?
Идея неплохая, если не учитывать, что двуокись свинца не самый лучший проводник электричества. Поэтому двуокись всегда наносится на хорошо проводимую подложку и не очень толстым слоем. Набивая в чулок вы делаете слой очень толстым, образуете массу мелких частиц имеющих плохой контакт. В итоге такой электрод не может работать из-за высокого собственного сопротивления, а также из-за излишне разветвленной поверхности. На такой поверхности не получится достич необходимой плотности тока, необходимой для электролиза. Приведенная плотность тока будет существенно ниже рекомендуемой.
-
Несмотря на кажущуюся простоту получения натрия электролизом расплава NaCl, при практической реализации этого метода возникает целый ряд весьма серьёзных технических проблем;
Для "домашнего" получения это не имеет никакого значения. Любой человек знакомый с ТБ на производстве покончит жизнь самоубийством, увидев любую из установок, которые "кулибины" используют для получения металлического натрия электролизом расплавов (хлоридов, гидроксидов) в домашних условиях. Технические проблемы просто игнорируются при производстве "на коленке". Ну кого там интересует шлам на электродах, или хлор загрязненный СО2? Все тупо сбрасывается на свалку или в атмосферу и меняется на новое практически без учета стоимости и т.п.
Поэтому для "дома" именно электролиз расплава хлорида натрия имеет первостепенное значение. А температуру плавления можно понизить добавляя хлорид кальция (смесь 60% CaCl + 40% NaCl) плавящуюся при ~ 510 C и имеющую рабочую температуру около 600 C
Известно, что при 800 градусах, необходимых для плавления NaCl, натрий имеет слишком высокое давление паров и можно устроить знатный фейерверк в случае малейшей негерметичности.
В дальнейшем, при частичной выработке NaCl, он добавляется в расплав. Извините, сумбурно вышло, но основную идею я, надеюсь, донес.
P.S. Хотя, признаюсь, я бы вел электролиз гидроксида натрия, который получаю по ртутному методу. Так как технически это проще и экологичнее.
Информация к размышлению: Подвергая электролизу растворы солей щелочных металлов в орагнических растворителях (Ацетон, Пиридин, Диметилформамид, пропиленкарбонат) можно получать металлические осадки.
Как мне видится данный процесс: ячейка охлаждается модулями пельтье до -30 и эта температура поддерживается. Электролиз ведут при относительно малых мощностях - для получения 50 г в день достаточно тока 2-3 А. Ячейка теплоизолируется пенопластом. Переместить натрий с катода ножем в керосин - секунда.
-
В общем, похоже из дохлых MB можно много ценного наковырять для БП гальваники

Там полно компонентов пригодных для "домашнего" использования в целях электролиза и гальваники в частности. Есть одно НО. Для этих компонентов нужны соответствующие им системы управления. А это уже другая схемотехника. Выпиливание из материнок доступно не всем, а тупо расковырять не подходит. Требуется выпайка и относительно бережное отношение - компоненты часто боятся статики и пробиваются на ура напряжениями от 100 вольт. Требуется некоторая оснастка отличная от молотка и чьей-то матери.
Чем плох этот источник компонентов? - да тем, что вы не найдете 5-10 одинаковых материнок и соответственно одинаковых деталей. А городить огород на разношерстных компонентах не комильфо ниразу.
Как человек собрающий БП для "домашнего" электролиза скажу, что под эту задачу лучше компонентами запасатся в любом магазине электроники (Платан, дельта-электроника, База электроники и т.п. А еще лучше на ebay - там дешевле всего, иногда в разы по сравнению с тем же Платан-ом) Просто потому, что при пуско-наладке они имеют свойство дымится
 . Ну и естественно на вторичном рынке можно затарить компонентов и расходников - молоток.ру, авито и т.п. Часто есть очень "вкусные" предложения. За гроши (по цене металлолома) продают вещи и изделия которые в магазинах с очень грустными ценниками.
. Ну и естественно на вторичном рынке можно затарить компонентов и расходников - молоток.ру, авито и т.п. Часто есть очень "вкусные" предложения. За гроши (по цене металлолома) продают вещи и изделия которые в магазинах с очень грустными ценниками.С молотка можно нарыть компонентов на 1 тыс и сделать линейный БП на 300 Вт. При 12 вольтах это 25 А. Для дома вполне достаточно.
А какая обычно емкость у батареи конденсаторов?
Это целиком и полностью зависит от конденсатоов в этой батарее. Обычно их собирают в батареи с целью увеличения емкости. Среди радиоинженеров есть практическое правило гласящее, что при нагрузке 1А конденсатор емкостью 10 000 мкф сглаживает пульсации до уровня 0,1В.
Соединяют в батарею также с целью снижения внутреннего сопротивления емкости.
Есть в продаже электролитические конденсаторы по 1-3 фарады расчитанные на 14 вольт. Используют в автомобильных аудиоусилителях.
-
-
нужна очень высокая наполненность связующего (эпоксидной смолы) 70-80% как минимум. Воторых желательно иметь смесь из нескольких фракций графита отличающихся по размерам частиц в 5-10 раз. Например такого ряда 10 мкм - 70 мкм - 350 мкм. Этим вы достигнете еще большей наполнености до 90%. тогда можно ожидать неплохой проводимости.
-
Я тоже об этом сейчас думаю. Ведь нитросоединения считаются самыми изученными. Просто не хочется отталкиваться от непонятно чего. Нитрующую смесь хочется применять стандартную. Остальное вроде опытным путём получено.
Нет стандартной нитрующей смеси. Её состав и требуемое количество зависит от того, какое соединение нитруют. Есть легконитруемые вещества. Спирты например. Там состав один. Есть труднонитруемые. Бензол, например. Там состав другой. А есть например амины - уротропин. Для его нитрации нужен вообще другой состав нитрующей смеси, серной кислоты там нет. Вместо неё берется уксусный ангидрид. Есть примеры нитрующих смесей с оксидом фосфора в качестве водоотнимающего вещества. Перечислять можно до упаду.
В каждом конкретном случае, для каждого вещества есть оптимальное соотношение компонентов и модуль.
А какая формула нитрующей смеси, а то я не нашел
У нитрующей смеси нет строгой формулы. Её "формула" зависит от содержания составляющих компонентов. Не забивайте себе глупостями мозг.
-
derba: Ок, понял.
MrTOCSY: мощность источника питания не столь важна. Полагаю источника Б5-67 или Б5-50 будет более чем достаточно.
Вполне возможно, что хватит любого лабораторного с напряжением до 36 вольт. Например Б5-47
Мощности как таковой в процессе электрофореза нет. Там ток маленький. Важнее напряжение так как среда слабоэлектропроводна.
-
Я вообще химию не знаю. Мне хотелось бы там увидеть полные решения трех задач.

Не может такого быть, чтобы вам не обьясняли как это решать, но спрашивали полные решения.
-
Как тогда лучше конц-трировать аптеч. Н2О2???
Лучше всего перегнать под вакуумом. Но с учетом того, что требуется чистая посуда, а культура производства в домашних условиях не отличается от нуля - это не способ.
Еще способ: электролиз раствора серной кислоты с получением надсерной кислоты и её разложения на переоксид водорода и серную кислоту. Которую снова пускают в цикл, после отгонки перекиси водорода.
Аппаратурного оформления не даю, так как на практике не получал. Знаю, что раствор кислоты надо сильно охлаждать ( полагаю не хуже чем до 0 градусов)
Из соображений "на вскидку" - ведем электролиз в ванне без диафрагмы, с рубашкой охлаждаемой рассолом (сам рассол циркулирует через морозилку) или элементами пельте, если у вас хай-тек электролизер. Электроды - графит. Как себя поведут в сернокислотном электролите я не знаю. Можно один из них взять свинцовый - Анод. В сернокислотных электролитах он хорошо себя ведет.
-
чисто гипотетически - да.
Но на самом деле серной кислоты надо больше. Почему - потому что в процессе нитрования выделяется вода и её надо связывать. Связывается она серной кислотой 1:1 - 3:1 (3 серной)
Мало того, что серной кислоты берется больше. Так еще и модуль ванны берется до 10-20. (избыток нитрующей смеси от теории)
А в процессе работы оказывается, что нитропродукт растворяется в нитрующей смеси и, черт побери, чтобы его выделить, смесь надо разбавлять водой. Поэтому на любом производстве основная статья расходов это чрезвычайный расход нитрующей смеси. А её рекуперация стоит больших затрат как капитальных так и текущих.
Из опыта нитрования могу сказать, что оптимальная смесь состоит из 2 массовых части серной кислоты и 1 массовой части азотной (при концентрациях H2SO4 = 95%, HNO3 = 98%) Тогда, если аккуратно посчитать экономическую состовляющую, получается наиболее выгодное соотношение. Между расходами на нитросмесь, на сырье, на выделение нитропродукта и его очистку.
-
после слов "оксид графита образует коллоидный раствор" 99,9% перестают читать внимательно.
Есть подозрение, что оксид графита образует не колоидный а истинный раствор. (о каком, кстати, оксиде идет речь о II или IV ? )


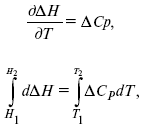






хэнд мэйд электролизер
в Электрохимия
Опубликовано · Изменено пользователем ТоптуновПотапов
Никакой. Алюминий активный металл и электроды распадутся (катод). Лучше взять две ложки из нержавейки. Электролит - раствор щелочи (средство "крот" например)