Поиск
Показаны результаты для тегов 'Пиридин'.
Найдено 9 результатов
-
В общем, всем привет, я сейчас читал книжку по неорганике и там была написана такая фраза: бромная вода обесцвечивается в реакциях с альлдегидами, ароматическими углеводородами кроме бензола Окей, толуол не обесцвечивает, но в его основе бензол. Фенол обесцвечивает с выпадением осадка) А вот нафталин вроде бы при н.у. реагирует)) Как ведут себя такие соединения, как пиридин, антрацен в отношении к бромной воде?) Я чёт туплюю) Как в общем понять, что оно будет реагировать с бромной водой?/
- 1 ответ
-
- бромная вода
- опечатка
-
(и ещё 3 )
C тегом:
-
При протонировании пиридинового гетероцикла произошло следующее: 1. Появился сильно уширенный сигнал N+H в ЯМР1Н 2. Мультиплеты других H гетероциклического фрагмента превратились в синглеты в ЯМР1Н. 3. Исчезли кросс-пики H гетероциклического фрагмента в спектрах COSY и HMBC, но сохранились HSQC. Это норма? До протонирования спины не падали, да и метилирование по пиридиновому N их не роняло. P.S. Записать NOESY не предлагать, так как в 3 положении пиридина особый заместитель, который не позволяет подобрать время смешения для корректной регистрации кросс-пиков.
-
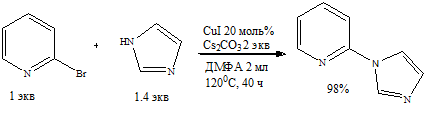
По Китайской методике 10.1021/jo0712289 поставил синтез. Иодид меди (I) свежеприготовленный использовал. По данным ТСХ и ГХ-МС 2-бромпиридин прореагировал полностью. Однако ГХ-МС зафиксировал лишь следы целевого продукта. Основной продукт детектируется по ТСХ, но не ГХ-МС. Это не имидазол, так как метчик имидазола менее подвижен на ТСХ, хотя имидазол тоже не детектируется методом ГХ-МС. Это и не целевой продукт, так как Китайцы успешно анализировали методом ГХ-МС. Что я получил вместо целевого продукта? Cs2CO3 куплен на настоящем форуме.
-
Уважаемые органики, обращаюсь к вам за помощью. Провожу реакцию между алкилирующим агентом ((адамантил-1)бромметилкетон) и производным фенола ([имидазол-1-ил]метилфенол) в пиридине в присутствии нитрата серебра. Мог бы провести реакцию по классической схеме, как обычно алкилируют фенолы (ацетон/ДМФА, поташ, при кипячении). Но проблема в том, что данный фенол имеет плохую растворимость. Не растворим в ацетоне как при комнатной температуре, так и при нагревании. Тоже самое с ДМФА. Только растворяется он при кипячении, но сами знаете, ДМФА разлагается, поэтому кипятить с данным растворителем не следует. Поэтому решил провести синтез в пиридине и с азотнокислым серебром в качестве электрофильного катализатора, способствующего поляризации связи углерод-бром в алкилирующем агенте. Казалось, добились того, что наконец-то данный фенол был растворим, система гомогенна. Провели реакцию, вылили в лед, чтобы выделить наш органический продукт. Образовался белый осадок. Конечно, еще должен образовываться бромид серебра, но продукт основной можно отмыть аммиаком от данной соли. В итоге оставив его седиментироваться, в конечном итоге осадка и след простыл, а на дне тонкая прослойка в виде не пойми чего. Поэтому хотелось бы узнать, как вы думайте, почему осадок исчез. Ведь органика, как мы знаем, почти вся не растворима в воде. На фотографии представлен тот самый образовавшийся осадок.
- 6 ответов
-
- фенол
- о-алкилирование
-
(и ещё 2 )
C тегом:
-
Доброе время суток! Необходимо синтезировать 3-метил пиридин из пиридина с выходом конечного продукта не меньше 60%. Так как данная реакция будет использована в промышленных целях, процесс по синтезу должен быть рентабелен. Спасибо за понимание. Будем рады сотрудничеству.
-
Интересуют информация по сольватации электрона пиридином, замещенными пиридинами и ДМСО. Конкретно интересуют условия при которых происходят эти феномены и доказательства их осуществления. Условия не связанные с подачей электрического тока особенно интересны. То есть химические способы получения сольватов электрона этими растворителями. Однако если у кого есть инфа по их электрохимическому получению то тоже буду благодарен. Особенно ценны ссылки на статьи в журналах. Интерес не праздный, так как есть подозрение, что они у меня получались.
-
Здравствуйте, такое задание: уравнение реакции и условия получения нитропроизводных пиридина + объяснить ориентацию электрофильного заместителя в этой реакции
- 3 ответа
-
- нитропроизводные
- пиридин
- (и ещё 2 )
-
Получение из пиридина альфа пиридинкарбоновой кислоты
nastenasimon опубликовал тема в Решение заданий
Необходимо получить из пиридина альфа пиридинкарбонову кислоту!!!! как это сделать????????????? -
Уважаемые химики помогите пожалуйста написать механизм реакции растворения сульфотриоксида в пиридине: