Поиск
Показаны результаты для тегов 'энтропия'.
Найдено 27 результатов
-
Как найти энтальпию, энтропию и теплоёмкость в Hyperchem 7?
rapnat опубликовал тема в Физическая химия
Доброго времени суток. Дорогие знатоки, кто про в hyperchem 7! Подскажите пожалуйста, как в hyperchem 7 у вещества посмотреть энтальпию, энтропию и теплоемкость (ΔН, ΔS, Cp)???- 2 ответа
-
- hyperchem
- термодинамика
- (и ещё 4 )
-
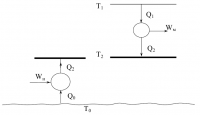
Помогите, пожалуйста! (Если что-то не понятно по условиям, то смело спрашивайте=)) Q2 = 100 кДж, Т0 = 298 К, Т1 = 800 К, Т2 = 370 К, Кн = 0,4, Км = 0,5 Рассматривается два случая подвода теплоты Q2 потребителю при температуре Т2 . В первом случае Q2 подводится путем передачи теплоты от окружающей среды (Т0) с помощью теплового насоса. Во втором случае теплота подводится от топливной энергоустановки с температурой Т1 (см. рис.). Для теплового насоса коэффициент преобразования ϕ работы Wн в теплоту Q2 = ϕ*Wн, передаваемую потребителю при температуре Т2, равен ϕ = Кн*ϕТ, (0
-
Здравствуйте! Вопрос звучит так: Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению: Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г); ∆rН0298= +34,55 кДж. По моим расчетам энтропия системы равна: ∆S0. = 3*60,75+ 213,68 - 146,2 - 197,4 = 52,33 Дж/моль*К Данные брала из справочника. ∆H0 = 34,55 кДж/моль (по условию) = 34550 Дж/моль Tравн = ∆H0/∆S0 = 34550 Дж/моль / 52,33 Дж/моль*К = 660,23 К Но я нашла на сайте вечернего отделения МГУ эту задачу с данным ответом, там Травн = 1102,4 К. Но ведь получается совсем другое число. Помогите разобраться в этом.
-
Вычисляя изменение энергию Гиббса для реакций горения алюминия и бора: 2AL+1,5O2 → AL2O3 2B+1,5O2 → B2O3 При различных температурах Т=298, 1500 и 3000 К; увидел что изменения энергия Гиббса уменьшается. Никак не могу разобраться где ошибка. Энтропию и Энтальпию выписал из справочника; нашел только, [Al2O3] и [b2O3] - в кристалической форме, таблица прикреалена. 1) 2AL+1,5O2 → AL2O3; Находим ΔH и ΔS: ΔH = -1675.7 = -1675.7 кДж/моль; ΔS = 50.9 – 2*28.3 – 1.5*205.2 = -313.5 Дж/моль*К-1; Найдем ΔG для T=298 K: ΔG = -1675.7 - 298 *(-0.3135) = -1582.277 кДж/моль; Для T=1500 K: ΔG = -1675.7 - 1500 *(-0.3135) = -1205.45 кДж/моль; Для T=3000 K: ΔG = -1675.7 - 3000 *(-0.3135) = -735.2 кДж/моль; 2) 2B+1,5O2 → B2O3; ΔH = -1254 = -1254 кДж/моль; ΔS = 78– 2*5,9 – 1.5*205.2 = -241,6 Дж/моль*К-1; Найдем ΔG для T=298 K: ΔG = -1254 - 298 *(-0.2416) = -1182,0 кДж/моль; Для T=1500 K: ΔG = -1254 - 1500 *(-0.2416) = -891,6 кДж/моль; Для T=3000 K: ΔG = -1254 - 3000 *(-0.2416) = -529,2 кДж/моль; Использовал энтропии оксидов в твердой фазе. Получается, что система упорядочивается, а процесс-то горения!!! Как с этим бороться? В обоих примерах изменение энтропии отрицательно, но оксид алюминия при температуре 1500 К не плавится!
- 4 ответа
-
- Энергия Гиббса
- Энтропия
- (и ещё 2 )
-
Здравствуйте! Подскажите, пожалуйста, вывод полного дифференциала для энтропии. Спасибо!
-
Здравствуйте. Была задана задача, решение которой прикладываю. Задача проверена преподавателем и сказано, что решена она верно, однако температура равновесия получилась -120 К, он сказал написать вывод по работе и почему получилась такая температура и что она может означать.
-
Как изменяется энтропия системы в прямой и обратной реакции синтеза аммиака из простых веществ?
-
Здравствуйте! Помогите пожалуйста с задачами. Используя справочные данные, определите H298, S298, G298, приведенные в заданиях реакций; сделайте вывод относительно самопроизвольного протекания процесса при T = 298 K, для обратимых процессов определите условия равновесия. Для молекулы, данной под буквой д), определить атомарную энтальпию образования и среднюю энергию связи в молекуле. а) NO2 (г) = .N2 (г) + O2 (г) б) 2NO2 (г) = N2O4 (ж) в) N2 (г) = 2N (г) г) O2 (г) = 2O (г) д) HCl
-
- термохимия
- закон гесса
-
(и ещё 2 )
C тегом:
-
Помогите пожалуйста с заданиями,завтра сдавать,если можно с решением,заранее спасибо!! 1. Пусть в системе протекает реакция (Fe2Fe32)О4(т)+4Н2(г)=3Fe(т)+4Н2О(г) Рассчитать стандартную энтальпию реакции (кДж) Указать тип:экзотермическая/эндотермическая Рассчитать изменение стандартной энтропии(Дж/к) Рассчитать стандартную энергию Гиббса(кдж) реакции при 298 к Будет ли протекать самопроизвольно реакция в закрытой системе при стандартных условиях(т=298к) Рассчитать стандартную энергию Гиббса (кдж) реакции при 100к
-
Первый и второй закон термодинамики. Нужен взгляд со стороны)
puzzlikk опубликовал тема в Решение заданий
Задача 4. По стандартным энтальпиям образования веществ вычислите тепловой эффект реакции СаО(кр) + 3С(кр) = СаС2(кр) + СО(г) протекающей при стандартных условиях. Решение: Согласно первому следствию из закона Гесса ΔН0298 = ΔН0 СО + ΔН0 СаС2 – ΔН0СаО – 3ΔН0С = ( – 110,53) + (– 62,7) – ( – 635,09) – 3 ∙ 0 = 461,86 кДж Ответ: 461,83 кДж Задача 34. Учитывая, что энтальпия парообразования воды 43,89 кДж / моль, рассчитайте изменение энтропии при превращении 5 кг Н2О(ж) в пар. Решение: Рассчитаем изменение энтропии при превращении 5000 /18 молей Н2О(ж) в пар: Δ S0298 = n = 32685,4 Дж/К Ответ: 32685,4 Дж/К Задача 53. Возможно ли самопроизвольное протекание реакции SiО2(кр) + 2СО(г) = 2СО2(г) + Si(кр) при стандартных условиях. Определите температуру наступления равновесия. Решение: SiО2(кр) + 2СО(г) = 2СО2(г) + Si(кр) 1. найдем значения стандартных теплот образования и стандартные энтропии участвующих в реакции веществ СО(г) SiО2(кр) СО2 (г) Si(кр) ΔН0f,298, кДж/моль –110,53 –910,94 – 393,51 0 S0298 Дж/(моль•К) 197,55 41,84 213,66 18,83 Рассчитаем ΔН0298, Δ S0298 ΔН0298 = 2 • (–393,51) + 0 – 2 • (– 110,53) – (– 910,94) = 344,98 кДж Δ S0298 = 2 • 213,66 + 18,83 – 2 • 197,55 – 41,84 = 9,21 Дж/К ΔG0298 = ΔН0298 – Т • Δ S0298 ΔG0298 = 344980 – 298 • 9,21 = 342235,42 Дж ΔG>0, значит, при указанных условиях реакция термодинамически не возможна. Наступлению равновесия соответствует условие: ΔG0298 = 0 т.е. ΔН0298 – Т • Δ S0298 = 0 Т = ΔН0298 / Δ S0298 = 344980 / 9,21 = 37457К -
Всем здравствуйте! Помогите с решением. Определить возможность протекания реакции газофазного процесса CO+Cl2=COCl2 при 700К, если константа равновесия Кр при этой температуре равна 1,0685*10(в -4 степени), а парциальные давления всех реагирующих веществ одинаковы и равны 98540Па. Как я понял, надо рассчитать энергию Гиббса при 700К. По формуле ΔG=H-T*S, получается -15020. Энергия Гиббса
- 1 ответ
-
- константа равновесия
- энергия гиббса
- (и ещё 2 )
-
Рассчитайте изменение энтропии при нагревании (охлаждении) при постоянном давлении в интервале температур от 373 до 373 21 кг вещества этилового эфира, если известны его температура плавления и кипения, теплоемкости в твердом, жидком и газообразном состояниях, теплоты плавления и испарения. А так понимаю надо брать все температуры в справочнике, и составить уравнение теплоемкости тоже самим, или как? Взять значения просто и что с ними делать? Не понимаю как решать, помогите
-
Здравствуйте! Очень много вопросов по объемной термодинамической задаче. Долго набирала сообщение со всеми индексами, вопросами, размышлениями и полными формулами, но страница перезагрузилась, поэтому пишу все более кратко. Кратко даже лучше. Дано: Атв=Аг норм. Тсубл=300 К Ср не f(T) ΔН0(300)=30 кДж/моль С0(р,298)(Атв)=30 Дж/моль*К С0(р,298)(Аг)=40 Дж/моль*К найти: a) ΔrS0(250); б) ΔrН0(250); в) уравнение изотермы ХР; г) равновесный состав (давление паров Аг и к-во Атв при 300 К, если в предв.вакуумир.сосуд V=10л поместили 1 моль Атв. Мысли по задаче: Для вычисления а и б есть формулы; в задании все дано для расчета по ним, кроме стандартных энтальпии и энтропии реакции при 298К. Как их найти? Ведь в справочнике, конечно, нет значений для гипотетических А. И связан ли этот момент с фразой "теплоемкость не зависит от температуры" и с сублимацией (иначе этот процесс больше нигде не фигурирует)? Уравнение изотермы тоже написать достаточно просто, если прояснить для себя момент с а и б. А вот в случае с г) я даже не совсем понимаю, что требуется. Раз равновесное давление паров, то -- Кр?.. Какова схема решения? Еще, мой вопрос: если про момент начала наблюдения за реакцией ничего не сказано (н/р просто дано некое уравнение неорганической реакции), можно ли считать, что система, которую она описывает, находится в равновесии? П.с. Если какие-то вопросы покажутся Вам глупыми, не обессудьте, пожалуйста: я медик, который учится по пособию для студентов химфака, пока плавает, но все же хочет во всем разобраться.
-
- термодинамика
- энтропия
-
(и ещё 3 )
C тегом:
-
Уважаемые физхимики! Мне необходимо построить график зависимости энергии Гиббса от температуры в реакциях Ca(HCO3)2 → CaCO3↓ + H2O + CO2 Mg(HCO3)2 → MgCO3↓ + H2O + CO2 в диапазоне от 298°К до 373°К. А также при какой температуре начинаются и насколько полно протекают эти реакции. Я бы рассчитал по методу Тёмкина-Шварцмана, но в сети отсутствуют значения энтальпии и энтропии гидрокарбонатов. Также нет этих данных в "Кратком справочнике..." Как быть, если гидрокарбонаты хорошо расворяются в воде? Заранее благодарю!
- 2 ответа
-
- физическая химия
- энтальпия
- (и ещё 4 )
-

Как рассчитать изменение энтропии при нагревании метана?
catlaster опубликовал тема в Решение заданий
Рассчитать изменение энтропии при нагревании 8 кг метана от 300 до 500 К, теплоемкость ср° = 17,45 + 60,46-10^-3 Т Дж/моль-К. -
Оценить температуру, при которой возможно самопроизвольное разложение воды на водород и кислород (энтальпии образования воды (ΔHof) и энтропии (So)известны): 2H2O(газ) = 2H2 + O2 ΔHof кДж/моль -241.81 0 0 So Дж/моль*К 188.72 130.52 205.05
- 8 ответов
-
- термодинамика
- энтропия
-
(и ещё 1 )
C тегом:
-
Нужно решить задачу. определить, будет ли окисляться железо сухим кислородом с образованием продуктов FeO и Fe2O3 при температурах 25*С и 150*С. Я так понял, что нужно написать сначала реакции образования оксидов. Потом для каждой реакции вычислить энтропию реакции и энтальпию. А оттуда по формуле ΔG=ΔH-TΔS вычислить изменение энергии Гиббса, по которой можно будет определить термодинамическую вероятность протекания коррозии. Так вот, я не знаю как найти значения ΔH и ΔS для реакций, помогите пожалуйста. Fe+ O2=> FeO Fe(|||) + O2 => Fe2O3
-
Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите ∆S°298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Помогите, пожалуйста, а я заояница, никак справится не могу)
-
Ребят помогите с решением задачи Во сколько раз необходимо увеличить объем идеального газа (n = 5 моль) при изотермическом расширении, если его энтропия увеличилась на DS=57.6 кДж/моль? Есть вот решение , но ответ некорректный получается по моему сильно большые цифры...... Предложите свои решения плс)
-
Пожалуйста, помогите ответить на вопросы: 1. Энтропия уменьшается в процессе: А. реакции А+В↔С Б. растворения кристаллов соли в жидкости В. смешивании этилового спирта с водой Г. образование паров йода из кристаллов 2. Энтропия уменьшается в процессе: А. Гидролиза крахмала Б. Окисление жирных кислот до углекислого газа и воды В. Синтеза белка Г. Горения целлюлозы
-
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите ΔG0298 реакции, протекающей по уравнению NH3(г) + НCl(г) = NН4Cl(к) Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: -92,08 кДж. С ответом не сходится, такое возможно или у меня ошибка?
-
1) определить возможность самопроизвольного протекания реакции при нормальных условиях ( энтальпия образования (ΔНf) и энтропии (S) веществ известны): O3 + H2O2(жидк)=2O2+ H2O(жидк) ΔfH 142,26 -187,86 0 -285,83 S 238,82 109,6 205,05 69,95 2) в каком случае энтальпия образования веществ А будет больше ΔfH (A кристалл) или ΔfH (A жидк)?
-
Как определить возможность образования CaF₂ из ионов в растворе?
mnk опубликовал тема в Решение заданий
Определите возможность образования кристаллической соли из ионов в растворе при Т=298К и стандартных состояниях всех компонентов растворов. реакция: CaCl(2р-р)+KF(р-р)--->CaF(2к)+KCl(р-р) помогите,ребят,завтра типовик сдавать! -
Мне необходимо рассчитать энтальпию и энтропию реакции, но обе получаются разных знаков, а когда рассчитываю Т равновесия - она мало того, что до фига большая, так ещё и отрицательная (в кельвинах ведь!). Где у меня ошибка?