-
Постов
128 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Папа_школьника
-
-
4 часа назад, sibra сказал:
Почему именно из иностранных? Хороший по каким критериям? По картинкам?
По критериям: полнота изложения, простой язык (без высшей математики, желательно), картинки с хорошей полиграфией. Визуализация важна - как иначе структуру молекул представлять, пи и сигма связи всякие, кристаллы и т.д.
Совета спрашиваю именно про иностранные, потому что отечественные и я так в книжном магазине полистать могу, чтобы понять.
-
38 минут назад, yatcheh сказал:
Перекись натрия тоже может быть окислена до надпероксида
Na2O2 + O2 ----> 2NaO2
При нагревании в чистом кислороде при 150 атм.
Ну, вообще-то это не "школьные" реакции. Не надо задуривать голову восьмикласснику

Спасибо. Вопрос-то был в другом - может или не может K2O реагировать с O2? Мы знаем, что оксиды бария и натрия это делают с образованием пероксидов. Вы и ваши коллеги здесь мне дали кучу информации про пероксиды и их использование, и что перекись натрия может быть окислена до надпероксида, и почему пероксид калия легко в надпероксид переходит, но только не дали ответ на тот самый вопрос:
МОГУТ ЛИ ПОПАРНО РЕАГИРОВАТЬ K2O + O2 ? И ЧТО В РЕЗУЛЬТАТЕ ПОЛУЧАЕТСЯ? АВЕРСУН ПРЕДПОЛОЖИЛ, ЧТО ПОЛУЧАЕТСЯ НАДПЕРОКСИД. И ЭТО ТОЖЕ ОТВЕТ ("да, могут"), НО ТОЛЬКО Я ЭТОЙ РЕАКЦИИ НИГДЕ НЕ ВИЖУ В ИНТЕРНЕТЕ (в отличие от О2 с оксидами бария и натрия)А что это рановато для 8-го класса, то я согласен. Учительница даёт упражнения целыми страницами, не особо вникая.
-
Посоветуйте пожалуйста минимально необходимый набор посуды и прочего (в т.ч. реактивов) для уровня 8 класса? Может, уже кто-то свёл в одном месте это всё, а если нет - то хотя б по названиям - типа, несколько пробирок таких-то, бюреток таких-то горелка такая-то 1 шт., и т.п.
Сыну в школе преподают теорию бегом, еще они решают задачки, а из опытов только дают подержать в руках минералы.
Они сейчас как раз проходят реакции оксидов металлов/неметаллов между собой, с кислотами, основаниями и т.п.
И где это всё можно купить.
(Ну и сам я тоже хочу посмотреть, как оксид фосфора 5 вытесняет азотный ангидрид, это да)
-
Уважаемые химики,
а посоветуйте, если можете, хороший базовый учебник из иностранных? Типа, на 1-й курс колледжа. Хочу книгу, где написано "про всё" и с учетом последних теорий, но чтоб на понятном языке и без высшей математики. И чтоб с красивыми картинками. Нарыл вот несколько ссылок. Цены, понятно, ломовые, так что есть только 1 попытка ))
https://www.amazon.com/gp/product/0073402753/ref=ox_sc_act_title_1?smid=A2D0JQ9WUE14PM&psc=1
https://www.amazon.com/gp/product/0134302389/ref=ox_sc_act_title_2?smid=A2A6UJBU2SRBU3&psc=1
https://www.amazon.com/gp/product/0134414233/ref=ox_sc_act_title_3?smid=ATVPDKIKX0DER&psc=1
https://www.amazon.com/gp/product/0132931281/ref=ox_sc_act_title_4?smid=AKGI8H47U3RBM&psc=1
https://www.amazon.com/gp/product/0198768125/ref=ox_sc_act_title_5?smid=ATVPDKIKX0DER&psc=1
https://www.amazon.com/gp/product/0134291808/ref=ox_sc_saved_title_1?smid=ATVPDKIKX0DER&psc=1
Спасибо вам.
-
33 минуты назад, yatcheh сказал:
Оксид K2O совершенно не характерен для калия и его тяжёлых аналогов. Он может быть получен при взаимодействии калия с недостатком кислорода с последующей отгонкой избытка калия в вакууме. При 430С он дисмутирует с образованием перекиси:
K2O ----> K2O2 + K
Перекись легко реагирует с кислородом:
K2O2 + O2 ----> KO2
Надперекись устойчива до 530С
У цезия и рубидия такое поведение ещё более ярко выражено.
Стабилизация надпероксид-аниона O2- связана с большим размером катиона и его слабым поляризующим действием.
Спасибо. Понял, что перекись из-за больших катионов легко вмещает еще кислород и сразу же становится надпероксидом. Ну то есть вот такая реакция, правильно?
2 K2O + 3 O2 = 4 KO2
Хоть как-то оксид калия с кислородом реагирует "попарно"? (приложил вопрос)
-
15 минут назад, aversun сказал:
Вероятно прямой реакцией с кислородом не удается получить пероксид, получается надпероксид.
То есть от К2О сразу к КО2, минуя К2О2? Я понимаю, что наличие неизведанного и делает химию таким интересным занятием, но всё же:
оксид бария в реакции с О2 даёт пероксид:
ВаО + О2 + t = ВаО2
оксид натрия аналогично:
Na2O + O2 + t = Na2O2
Почему ЖЕ оксид калия, ближайшего родственника Na, ведёт себя по-другому? Должно же быть простое объяснение? На мой взгляд, они различаются только размером катиона. Тот есть получается,
кристалл Na+ O2- Na+ может вместить в себя еще один атом кислорода и стать Na+ O1--O1- Na+, а кристалл К+ O2- К+ принимает сразу три атома (ПОЧЕМУ не один?) и становится двумя кристаллами К+ О1-=О ?
-
11 минут назад, aversun сказал:
Спасибо, но там нет реакции нормального оксида калия К2О с О2. Есть только с калием. И есть обратная реакция - разложение К2О2 на нормальный оксид и кислород с температурой:
К2О2 +t => K2O + O2
18 минут назад, M_GM сказал:Пероксид калия существует и даже используется для поглощения СО2 на подводных лодках
https://ru.wikipedia.org/wiki/Пероксид_калия
Почему не упоминается конкретная реакция? Возможно она не имеет практического значения.
Пероксид без сомнения существует. Вопрос был: происходит ли следующая реакция, а если нет, то почему?
2 K2O + O2 + t => K2O2
-
Задание определить попарно реагирующие. Даны (среди прочего) BaO, K2O и О2.
В интернете нашли образование пероксидов из BaO и Na2O (+O2 + t), но не из K2O. Что с калием не так, особенно по сравнению с Na? Ионы больше по размеру и поэтому дополнительный кислород не помещается в кристалле? Но вообще же Ka2O2 существует? Почему не упоминается реакция типа
2 Ka2O + O2 + t => K2O2
аналогично натрию?
Спасибо!
-
22 часа назад, aversun сказал:
Водород однозначно будет выделяться, иначе откуда гидроксиды возьмутся.
2.
алюминат кальция тоже может быть, но это зависит от количества кальция в сплаве.
4-й вопрос, это что за "алюминий оксиды алюминий"?
Уважаемые aversun,
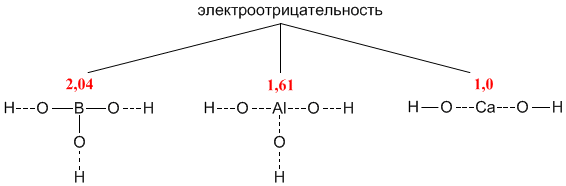
а не могли бы вы пояснить роль электроотрицательности. Не могу понять. С одной стороны, ученые сообщают, что алюминий как более активный металл вытесняет менее активные из их оксидов - типа,
3 Fe3O4 + 8 Al + t = 4 Al2O3 + 9 Fe
При этом э.о. алюминия 1.61, железа 1.83. Т.е. создается новая связь, где разница между э.о. кислорода и металла становится больше. Но почему в гидроксидах не так? Разница между В и О 1.4, а между Са и О - 2.4, но тем не менее разрывается именно связь с большей разницей э.о.? Или типа пока она ковалентная полярная, то держит, а как только становится ионной - легко разрывается?
Терзают сомнения, что что-то здесь еще есть. Может, дело в длине связи в случае разных валентных уровней?
----------------------------------------------------------
Соединение B(OH)3 имеет внутри молекулы наиболее "ковалентную" связь бора с кислородом, поскольку бор ближе по электроотрицательности к кислороду, чем Al и Сa. Из-за высокой электроотрицательности бору энергетически выгоднее входить в состав отрицательно заряженной частицы – то есть кислотного остатка. Поэтому формулу B(OH)3 чаще записывают как H3BO3:
H3BO3 = 3H+ + BO33- (в растворе)
Кальций – наименее электроотрицательный из этих элементов, поэтому в его молекуле связь Са–О носит ионный характер. Из-за низкой электроотрицательности для кальция выгодно существование в виде катиона Ca2+:
Ca(OH)2 = Ca2+ + 2OH- (в растворе)
В связи с этим в структурных формулах пунктирными линиями отмечены связи, разрыв которых энергетически более выгоден.
 23 часа назад, aversun сказал:
23 часа назад, aversun сказал:Водород однозначно будет выделяться, иначе откуда гидроксиды возьмутся.
А ионам водорода обязательно в Н2 соединяться? Они не могут в воде оставаться, делая её слегка кислой?
-
2 часа назад, Egor_pomidor сказал:
Нету в 8 классе такого.
Молярные массы проходят в 1-й четверти 8-го класса, но понятие "нейтрализации" - только в 3-ей. Хотя это где как.
-
-
-
11 часов назад, aversun сказал:
Спасибо, с формулой понятно! А как это происходит на электронном уровне?
Я имею ввиду, вот есть много MgO, это кристаллы, на каждый ион Mg++ приходится ион O--. Затем ливанули туда немного раствора серной кислоты, такой суп из H+ и SO4-- и H-OH.
И должна получиться основная соль Mg2SO4(OH)2. Про её свойства ничего не смог найти, предположим - это кристаллы, как и средняя соль.
Тогда в этом кристалле на каждой ион кислотного остатка должны приходиться по 2 иона Mg++ и по два гидроксид-иона ОН-. (вот нашел в википедии - Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: Na2[Zn(OH)4], Na2[Sn(OH)6] и др.)
С теми гидроксид-ионами ОН-, которые из воды - понятно, они уже в растворе.
Вопросы у меня такие:
(1)как и зачем ионам O2-, которые сидят себе в кристаллах MgO, формировать еще донорно-акцепторную (если я правильно понимаю) связь с Н+? Выигрыш в энергии?
(2) И как эта реакция с избытком оксида вообще выглядит? Посреди белых кристаллов оксида появляются кристаллы Mg2SO4(OH)2?
(3) что в центре у Mg2SO4(OH)2? Как соединение выглядит?
-
голову сломал, как обеспечить основность соли - ведь в этом смысл избыточности магния?
единственное, то приходит на ум - что-то типа
[HO-Mg]+ SO42- [HO-Mg]+ плюс H2O
то есть на каждый ион кислотного остатка приходится по два иона [HO-Mg]+ или наверно более правильно сказать по две пары OH- и Mg2+
И если оксида магния в избытке, то хватит ли водорода на воду?
Такое бывает вообще?
-
4 часа назад, llinks сказал:
Аналогия - натрий, такой рубаха парень, однорукий ( одновалентный, устойчивый ион ).
Алюминий - трехрукий ( трехвалентный, устойчивый ион ).
Кислород, у него две руки, может взять два натрия, Na2O .
С алюминием у кислорода получается Al2O3, понятно? ))
А например с марганцем сложно - у него семь рук ))
Обычно марганец пользуется 2 или 4 руками ( валентность ), и всеми семью, с кислородом MnO , MnO2 , Mn2O7 - устойчивые ионы у марганца нехарактерны.
Пардон, что влезаю... Тут где-то на форуме видел, что d-уровни устойчивы с 0, 5 или всеми 10 электронами. С MnO понятно - отдал 2, стал 3d54s0. Mn2O7 тоже - отдал все 7, стал как аргон 3s2 3p4 3d0 4s0. Но откуда валентность 4?
-
19 минут назад, M_GM сказал:
Потому что одновременно идет несколько реакций, и пожалуй первая из них:
CO2 + 4Na = 2Na2O+ C
А далее основной оксид натрия реагирует с кислотным оксидом СО2, (настолько, насколько успевает его ухватить):
CO2 + Na2O = Na2CO3
в результате среди продуктов будет и Na2CO3 и C + оксид натрия с достаточно произвольными отношениями между ними.
Не исключаю, что если натрий будет в большом избытке, то среди продуктов будtт и карбид натрия, как следствие реакции
2Na + 2C = Na2C2
Спасибо M_GM, спасибо aversun - вы супер!
Скажите только ещё, почему в первой реакции кислород меняет углерод на натрий? Потому что у натрия меньше Э.О. чем у С или по другой причине? Почему важно нагревание? Что меняет нагревание с т.зр. электронного строения? Тут же вроде нечему "распариваться"?
-
27 минут назад, aversun сказал:
Реагирует с образованием Na2CO3 + C + оксиды натрия
При сжигании (нагревании) в атмосфере CO2
Большое спасибо! А если бы можно было ровно по молекулам отмерять, то можно ли записать без оксидов натрия вот так:
4 Na + 3 CO2 = 2 Na2CO3 + 1 C
И если в левой части относительно много именно С, а не Na, то зачем справа появляться еще и оксиду натрия?
-
Про условия реакции ничего не сказано.
С одной стороны, разные генетические группы, почему бы не получиться чему-то типа: карбид Na+ C- =(тройная) C- Na+ и О2.
С другой стороны, в О=С=О две двойных связи, причем на 2-м уровне, т.е. крепкие и короткие. Может ли натрий вытеснить кислород из СО2, предложив взамен углероду 2 ионные связи? Наверно нет? Или тут совсем в другом дело?
В какую сторону думать-то? (это 8 класс)
-
4 часа назад, фосолиф-кимих сказал:
Да, SO2 - это sp2 гибридизация. Геометрия угловая. Может быть представлена резонансными формами: O--S+=O <-> O=S+-O- Пи связь образуется за счет p орбиталей. d орбитали в первом приближении - не связывающие орбитали.
Спасибо. Правильно ли я понимаю тогда, что у атомов кислорода здесь гибридизация: с одинарной связью - sp3, с двойной - sp2, а пи-связь как бы то ли на одном атоме, то ли на другом, типа блуждает?
И кстати, не мне конечно влезать в ученые споры, но вот тут (на 1:39 про серу) профессор университета Мэриленда считает, что правильная запись - это O=S=O, и ничего, что у серы 10 электронов, главное - по его формуле у всех атомов получается полный заряд 0. А вот это представление O--S+=O - как раз неправильное. Может, я чего не понимаю? Или это для американских студентов упрощено, чтобы резонансные структуры не объяснять?
-
53 минуты назад, фосолиф-кимих сказал:
SO существует, но дипропорционирует реагируя сам с собой. Причина в слабости пи связи вызванной чересчур длинной сигмой по сравнению с O2 .
SO2 имеет электронную структуру O3 .То есть d орбитали особо то и не нужны, хотя и вносят стабилизирующий вклад за счет вторичных возмущений.
О, сам нашел ответ. И ведь я же это уже читал ))
** Почему бы не предположить, что молекула озона имеет циклическое строение – в форме равностороннего треугольника? В такой молекуле валентность всех атомов кислорода была бы равна двум, как и во всех остальных его соединениях. Однако экспериментальные факты не подтверждают эту гипотезу. Во-первых, структурные исследования показали, что молекула представляет собой не равносторонний, а равнобедренный треугольник, один из углов которого намного больше 60o. Во-вторых, длина связи кислород-кислород (1,28 А) скорее соответствует кратной, а не простой связи (напомним, что длина простой связи О–О в H2O2 заметно больше – 1,48 А). В-третьих, молекула озона полярна. Все эти факты объясняют приведенные в начале параграфа формулы. Так, разделение зарядов "+" и "–" в резонансных структурах позволяет объяснить полярность молекулы озона (из-за этого озон намного лучше, чем O2, растворяется в воде). Кроме того, такое разделение зарядов эквивалентно еще одной химической связи и можно говорить, что у центрального атома кислорода валентность (IV). Аналогичная ситуация реализуется при образовании молекулы SO2, однако у атома серы валентность (IV) появляется благодаря переходу электрона с подуровня 3p на 3d (вспомните §3.5, где приведены нужные орбитальные диаграммы). Но у кислорода на 2-м уровне нет d-орбиталей! Как же в этом случае реализуется его четырехвалентное состояние? Вероятно, благодаря переходу электрона с уровня 2p на 3s в атоме кислорода. Эти уровни уже значительно отличаются по энергии, поэтому такой переход должен требовать больших энергетических затрат. Эксперимент говорит о том, что образование озона действительно требует поглощения большого количества энергии.
-
35 минут назад, фосолиф-кимих сказал:
SO существует, но дипропорционирует реагируя сам с собой. Причина в слабости пи связи вызванной чересчур длинной сигмой по сравнению с O2 .
SO2 имеет электронную структуру O3 .То есть d орбитали особо то и не нужны, хотя и вносят стабилизирующий вклад за счет вторичных возмущений.
Спасибо. Про про длинную сигма-связь понятно - расстояние между ядрами больше между S и O, чем между O и O. Про озон как-то не думал, а ведь действительно - как это делает озон, имея у кислородов только по два неспаренных электрона и не имея пустых орбиталей для донорной связи и не имея d-орбиталей для расспаривания? С какой орбитали центрального кислорода берется электрон для "полуторной" резонансной связи с двумя другими?


С серой понятно - один поднимается на d-уровень и полностью отдается кислороду, оставшийся участвует в сигма-связи. То есть промежуточный шаг "расспаривания на d" в озоне пропускается?
-
14 минут назад, yatcheh сказал:
ТС'у требуется обоснование сего феномена. Вопрос был в том - можно ли на основе знания химии на уровне 8-го класса вывести это обоснование чисто логическим путём, тэскать - "не эмпирически" ?
Это точно! Хотелось бы минимизировать всякие "а это надо запомнить" или "а почему так - вы узнаете в старших классах". Но объяснение про выигрыш в энергии - всё таки кое-что. Легко забрасывает электроны на d-подуровень, и выделение энергии от связей с двумя атомами О эти затраты окупает. Сойдет пока.
-
Всем доброго дня,
хотелось бы разобраться. Если для создания SO2 сера расспаривает электроны на d-подуровень, то не должны ли все 5 орбиталей участвовать в sp3d гибридизации с построением тригональной бипирамиды? Тогда к четырем вершинам двух граней крепятся атомы О своими тетраэдрическими sp3 орбиталями, а ещё в одной вершине - неподелённая пара? (примерно как я нарисовал ниже).

Что смущает - так то, что здесь вообще нет прямых связей ("сигма"), а есть только как бы по две боковые "пи" связи, и что делать с 10-ю электронами у серы в такой конструкции. Но если сера полностью отпускает один из общих электронов к кислороду , чтобы остаться с октетом (мой скромный рис.2), тогда вроде и нет нужды в sp3d гибридизации, всего остается 4 орбитали, минус одна "пи"-связь со вторым кислородом, то есть остается sp2 гибридизация и плоская угловая молекула О- -- S+ = O. То есть по сути, сера расспаривает свой p-электрон не чтобы поместить его на d, а чтобы тупо полностью отдать кислороду???

А именно так я и видел где-то в интернете - что SO2 - это просто sp2 гибридизация. Помогите понять, пожалуйста! Если долго объяснять, можно намёком+ гиперссылкой, а я там почитаю.
-
Благодарствую. Что-то в этом роде и я подозревал.

.thumb.jpg.8a6f751a33dd10b2b5836f441b0d541b.jpg)





Набор посуды и реактивов?
в Решение заданий
Опубликовано
Купили. "Большая химическая лаборатория" называется. Маркировка 12+. В коробке немалое количество баночек с реактивами. Даже 10% растворы соляной и азотной кислоты. Красочный буклет на 100 страниц с описанием порядка 90 опытов. ВНИМАНИЕ - ни в буклете, ни на баночках НИ ОДНОЙ ФОРМУЛЫ вещества, не говоря уже об уравнениях реакций.
Эксперимент №1 состоит в растворении в воде йодистого калия и сернокислой меди. Комментарий в буклете такой: "Образуется более насыщенный коричневый цвет, потому что вода растворит реактивы". Всё! Мы так и не поняли, что у нас диссоциировало и с чем соединилось. Я так понимаю, это было что-то типа
KI + CuSO4 + H2O = K+ I- Cu2+ SO42- H+ OH-
справа не встретилось ничего нерастворимого, а темно коричневый цвет дали просто анионы йода....
В эксперименте №3 предлагают растворить хлорид кобальта (формулы нет), а потом раствором написать что-то на бумаге. Бумагу затем прогреть. Опять никаких объяснений, что это за реакции. Раствор розовеет, написанное на бумаге после нагревания выступает бледно-голубым цветом. Если кто-нибудь сможет пояснить по реакциям, буду признателен.
Странно, что для 12+ не дано более подробного объяснения, хотя бы мелким шрифтом в приложении.