Поиск
Показаны результаты для тегов 'хлорид'.
Найдено 6 результатов
-
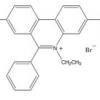
Смесь разбавленной серной кислоты с нитратом и хлоридом
nikanykey опубликовал тема в Неорганическая химия
будет ли она обладать свойствами царской водки, например имеется нитрат и хлорид кальция, магазинный электролит 1.4г/см3 или слабее, почитали пропорцию,смешали, может даже подогрели, отфильтровали на Шоте или стекловате ибо жалко Шот забивать, и вот она! или прямо пользовать in situ так, а гипс, так, нейтральная примесь.- 18 ответов
-
- царская водка
- нитрат
-
(и ещё 2 )
C тегом:
-
Здравствуйте! Продаётся хлорид цезия чистоты ОСЧ и ХЧ. Банки с хранения, но в хорошем виде, не вскрыты. Могу отфасовать от 50г, но фасовка ОСЧ CsCl нежелательна. При покупке больше килограмма можем поторговаться. Нахожусь в Москве, возможна отправка по России за счёт покупателя. В наличии 3кг CsCl ОСЧ (6,5 руб/г): А также 7кг CsCl ХЧ (5 руб/г):
-
Доброго времени суток, уважаемые химики. Когда-то давно мне здесь писали, что при бездиафрагменном электролизе раствора NaCl может образоваться перхлорат натрия. Я поставил себе целью получить его таким образом. Кто-нибудь использовал этот метод при домашнем получении NaClO4? Какие ток и напряжение оптимальны и безопасны для данной цели? Как потом очищали полученный перхлорат от влаги и прочих хлорных солей? Заранее спасибо
-
При электролизе хлорида натрия одним из продуктов должен быть хлорат натрия. Так вот, не будет ли вместе с электролизом NaCl происходить электролиз хлората? И какие продукты будут в результате? И как выделить оттуда NaClO3?
- 3 ответа
-
- электролиз
- хлорид
-
(и ещё 1 )
C тегом:
-
куплю технический хлорид калия 2-3 кг, нитраты бария, стронция, натрия по 0.5 кг каждого классификация не ниже ч.
-
Раствор хлорида алюминия в воде имеет концентрацию 2,18 г - экв/л , а плотность 1.08 г/мл. К 50 мл этого раствора добавили 30 мл воды и его плотность стала 1.05 г/мл . Найти концентрацию полученного раствора в процентах по массе. Начала решать так: m(H2O)=V*p=30*1=30г Найдем массу первоначального раствора m1=V1*p1=50*1,08=54 г Найдем массу конечного раствора : m2=m(H2O)+m1=30+54=84 г Дальше нужно найти массу вещества в растворе. Как это сделать?
-
- концентрация
- плотность
-
(и ещё 3 )
C тегом:

