-
Постов
1906 -
Зарегистрирован
-
Посещение
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Ivan96
-
-
Ну да ладно .... Мне интересно , где такую проволоку берут , на вторичную обмотку , да хотя бы на 100 А ? . Каким трансформатор будет ?
А она вроде делается из обычной меди с ПВХ-оболочкой. Она выдерживает и больше, чем 100А. Конечно, частенько возникают короткие замыкания, но, несмотря на это, обмотку продолжают делать из меди. А для 5кА - наверное графит только и используют!
-
Если будет стоять несколько ванн - сопративление будет большим , чем с одной ванной . Есть такое явление , как суперпроводимость . Скорее вснего сдесь дело в этом .
Это при последовательном. Если параллельное, то сопротивление как раз будет меньше. Только вот для получения сверхпроводимости нужно очень сильно охлаждать проводник - жидким азотом к примеру. Это ж замучаешься!
-
Электролиз расплава получится ?

SiF4 - это вообще газ!
 :ag:
:ag: 
-
Но в любом случае , электроды для таких токов должны быть инертными .
Конечно, да и просто при таких токах медные электроды вообще могут расплавиться! А графит только возгоняется при 30000С. Вообще, графит - очень удобная вещь для электролиза.
-
Хотя нет, я "немного" ошибся - бывают токи и до 5кА! Для синтеза водорода из воды! Это ж сколько платить надо за электроэнергию...

И тогда мне непонятно, как добиваются такого низкого сопротивления электролита, если напряжение всего 5В?
По идее:
5В / 5000А = 0,001Ом
Это как такое сопротивление можно получить??? Может там стоят сразу несколько ванн, соединённых параллельно?
-
Как не странно , и при маленьком токе металлы ложатся рыхлым слоем (при восстановлении из хлоридов) . Я посоветовал больший ток прежде всего , что бы ускорить реакцию , на графит хром и так рыхлым сядет .
Чтобы металл ложился ровным слоем, напряжение наоборот делают очень маленьким, не больше 5В, а ток - большой, вплоть до 100А. Почему именно так - не знаю.

-
А если взять песок , промыть , и растворить в солянке ? А потом электролизом
Диоксид кремния не растворяется ни в каких кислотах, кроме плавиковой! Да и провести электролиз раствора фторида не получится.
-
...но также читал что хромовая кислота очень вредна (в том числе и пары).
Поэтому хотелось бы держаться от неё подальше и провести электролиз солей хрома (III).
Пусть не будет прочных хромовых покрытий - мне и не нужны устойчивые покрытия.
Мне нужен металлический хром сам по себе, а не с трудом отделимый от стальной основы.
Какие использовать электроды (особенно сложен вопрос выбора анода)?
Какие соединения хрома использовать - сульфат хрома (III) (в растворе будет оставаться серная кислота) или шестиводный хлорид хрома (III) (будет выделяться хлор)? Переводить безводный хлорид хрома (III) ради получения шестиводного не намерен - обратную бы задачу решить.
Мне кажется что сначала будут получаться соединения хрома (II) и лишь после полного перехода всех ионов Cr3+ в Cr2+ начнётся получение Cr.
Проблема в том, что, возможно, серная кислота будет растворять выделяющийся хром и он опять перейдёт в раствор. Так что лучше хлорид. Хлор будет выделяться - но это и не такая сложная проблема.
Напряжение брать лучше побольше (и ток тоже, как посоветовал Вова123), так как при этом покрытие будет неравномерным, и вам будет легче его счистить (вы же хотите хром не в виде покрытия, а в свободном виде?).
-
Щавелевая кислота дигидрат. Плавится в кристализационной воде, затем эта вода улетучивается в виде пара - это и есть "дымок".
А вообще:
Температура возгонки 125 °C
Температура разложения 100-130 °C
Температура декарбоксилирования 166-180 °C
А разве декарбоксилирование и разложение идут не одновременно? Щавелевая теряет углекислый газ и становится муравьиной.
-
Кремний можно выделить из сплава силумин, растворяя его в соляной ( лучше смесь электролит + хлорид натрия, так дешевле ).
Образуется в виде мелких блестящих кристаллов.
А где силумин применяется?
В транзисторах, кстати, тоже есть немало кремния!
-
Это общая реакция, муравьиная образуется, но быстро разлагается. Предотвращает разложение глицерин из-за образования эфира. Это один из способов получения муравьиной.
Я сегодня попробовал так получить муравьиную кислоту. Порошок щавелевой быстро превратился в прозрачную жидкость, полетел какой-то белый дымок. Но запаха кислоты не было! Неужели она разложилась? Вроде же для этого нужен водоотнимающий агент! Слава богу, угарником не траванулся...

-
Ни разу такого не слышал. Дело даже не в стойкости иона [siF6](2+), а в возможности (точнее - невозможности
 ) образования в водном растворе иона Si(4+).
) образования в водном растворе иона Si(4+).Возможно, получится восстановить какой-нибудь гексафторсиликат алюминием, а затем - промыть щелочью. Хотя тоже сомнительно. Наверное, придется все же идти через диоксид или тетрахлорид...
А почему так трудно восстановить диоксид?
-
Теоретически все получится
5Cr2O3 + 9H2SO4 + 6KMnO4 = 5H2Cr2O7 + 3K2SO4 + 6MnSO4 + 4H2O
Практически, т.к. в растворе будут присутствовать ионы H+, K+ и Mn+2 и анионы SO4-2 и Cr2O7-2, поэтому сказать, что вы получили хромовою кислоту можно только после того, как вы ее выделите.
А на самом деле провести вообще такую реакцию, думаю, будет весьма сложно, т.к. оксид хрома вещь довольно инертная и растворяется очень тяжело.
В разбавленной серке может и не пойти?
-
Собственно выделить наверное можно,но для начала какое-то количество надобно иметь.
Стекло растворяется в концентрированном растворе щелочи.
Если в раствор добавить спирта,то он расслаивается ... а дальше ... думайте сами ,решайте сами - моя не знать...
Кстати - совет с известью не катит,по той простой причине,что извести в продаже тоже нет...(надпись "известь" на пакете с доломитом не делает его оксидом кальция)...
Я делал так - прокаливал смесь гидрооксида алюминия с содой.Потом это дело в воду - гидрооксид в осадок,а щелочь получалась в растворе.
В продажах есть так называемая "Бордоская смесь" - это два пакета: с медным купоросом и негашённой известью. Известь настоящая - хорошая вещь. Так что это и не очень-то большая проблема.
-
А, ну здесь сразу представляют то, что муравьиная разлагается тут же, в момент образования?
-
Кто знает для 1л(объем ванны для электролиза) будет вполне достаточно 4А тока(12В)??? А 2А???
А что за электролит?
-
Здравствуйте!Можно ли получить кремний электролизом раствора Н2[siF6]? Если нет,то каким способом можно получить кремний в лаборатории(кроме металлотермии)? Заранее спасибо за ответ.
Получить можно. Кроме этого способа и металлотермии можно только восстановить углём (коксом).
-
Нашёл я тут на сайте такую реакцию:
5Cr2O3 + 3H2SO4 (разб.) + 2H2O + 6NaBrO3 = 5H2Cr2O7(р) + 3Br2 + 3Na2SO4
Получится ли получить дихромовую кислоту, если я заменю бромат натрия на перманганат калия? Всё-таки это тоже сильный окислитель.
-
А алюминотермией дома не сможете получить?
-
-
-
Сажа может и остаться. Да и зачем вам вообще беспокоиться по этому поводу? Уголь не мешает электролизу!
-
-
 Конечно не забыл . Кислоту у бабушки в падвале нашел , желтого цвета , вроди бы не дымит , но минут через 5 вся комната в тумане , есл открытым пузырек оставить .
Конечно не забыл . Кислоту у бабушки в падвале нашел , желтого цвета , вроди бы не дымит , но минут через 5 вся комната в тумане , есл открытым пузырек оставить .У вас техническая значит. Процентов 10-20%.


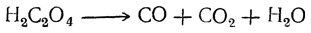
B2O3 в качестве водоотнимающего агента
в Общий
Опубликовано
Можно ли использовать борный ангидрид как водоотнимающий агент? Например, при получении сложных эфиров? Конц. серки и оксида фосфора пока нет.