Поиск
Показаны результаты для тегов 'аналитическая химия'.
Найдено 89 результатов
-
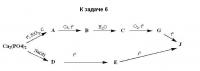
Итак, обещанная тема! В ней будут публиковаться задачки олимпиад краевого и выше уровней для тренировки. Краевая олимпиада 2001 - 2002 года, 10 класс, теоретический тур, Краснодарский край Задание 1 (15 баллов) Твёрдое при комнатной температуре вещество А содержит 50% (мол.) водорода. Оно не реагирует с водным раствором перманганата калия, а при действии бихромата калия в 30% растворе серной кислоты превращается только в кислоту Б, содержащую 58.5% углерода и 3.7 % водорода. Выделения газа при этом не наблюдается. При нагревании кислота Б плавится, после чего теряет воду и образует вещество В. Если А обработать нитрующей смесью при слабом нагревании, то среди многочисленных продуктов нитрования преобладают 3 соединения (Г, Д и Е) в соотношении по массе 1:1:1, с трудом поддающиеся разделению. Все эти соединения содержат 49,5% углерода, 3,1% водорода и 14,4% азота. При окислении любого из этих трёх соединений кислым раствором бихромата калия образуется только одно вещество - кислота Ж. Укажите вещества А - Ж и напишите соответствующие превращения. Задание 2 (12 баллов)При полной нейтрализации 200 мл соляной кислоты с массовой долей 0,0352 (p=1036 кг/м3) раствором КОН выделилось 11,18 кДж теплоты (условия стандартные). В реакции нейтрализации 500 мл 0,1 М уксусной кислоты при тех же условиях выделилось 2,38 кДж. 1) Определите молярную теплоту диссоциации воды. Ответ обоснуйте. 2) Предложите способ (теоретический или экспериментальный) определения молярной теплоты диссоциации воды. 3) Как меняется величина ионного произведения воды с ростом температуры. Ответ обоснуйте. Задание 3 (10 баллов) Элемент Х образует множество кислородсодержащих кислот. Содержание (в процентах по массе) калия, элементаХ и кислорода в калиевых солях некоторых из них приведено в таблице: 1) определите Х 2)запишите молекулярные и графические формулы кислот, дайте их названия и названия солей, указанных в условии. Задание 4 (8 баллов) При взаимодействии 1,0000 г сложного эфира некоторой органической кислоты с избытком раствора гидроксида натрия было получено 1,1356 г натриевой соли этой кислоты. 1) Установите формулу сложного эфира. 2) Составьте кинетическое уравнение и рассчитайте, во сколько раз увеличится скорость гидролиза эфира, если концентрацию эфира увеличить в3 раза, а концентрацию щёлочи в 4 раза. Медленной и равновесной считать 1-ю стадию присоединения ОН к эфиру. Задание 5 (5 баллов) Неизвестный металл массой 4,8 г обработали избытком очень разбавленного раствора азотной кислоты. К полученному раствору прибавили избыток раствора щёлочи и нагрели, при этом выделилось 1,12 л газа (н.у.). Определите металл, напишите уравнения реакций Задание 6 (4 балла) Осуществите следующие превращения:
- 1439 ответов
-
- Органическая химия
- Неорганическая химия
- (и ещё 7 )
-
Сколько г HCOOH растворено в 500 мл раствора, pH которого равен 2,62? KHCOOH = 1,78∙10-4.
-
Как правильно довести до метки окрашенные растворы? И Как довести прозрачные растворы?
- 1 ответ
-
- химия
- аналитическая химия
-
(и ещё 3 )
C тегом:
-
Определение хрома в воде проводили атомно-абсорбционным методом по способу добавок. В мерные колбы 50,0 см3 ввели пробы анализируемого и стандартного (12,0 мкг/мл) растворов хрома, разбавили до метки водой, распылили в пламя ацетилен – закись азота и измерили оптическую плотность при 357,9 нм. Результаты приведены ниже: Объем анализируемого раствора, см3 10,0 10,0 10,0 10,0 Объем стандартного раствора, см3 0,0 10,0 20,0 30,0 Оптическая плотность 0,205 0,296 0,383 0,472 Какова концентрация (мкг/см3) хрома в анализируемом растворе?
-
рН-метр исследовательского класса практически даром - ниже себестоимости. мы купили его за 4000 евро в прошлом году Mettler Toledo. Новый в запечатанной коробке. рН-метр S80 SevenMulti - двух-модульный для проведения ион-селективных/рН/ОВП измерений. можем отдать в добрые руки за символические деньги для прибора этого класса. Описание: http://www.argentum107.ru/?m=prosp&an=AUB6 Сейчас снят с производства. Его замена S500 - от 500т.р.
- 1 ответ
-
- рн-метр
- кондуктометр
- (и ещё 8 )
-
Навеску цветного сплава массой 0,6034 г. растворили и после отделения мешающих ионов раствор, содержащий висмут, оттитровали 19,50 мл. 0,01078 М ЭДТА с пирокатехиновым фиолетовым в качестве индикатора. Вычислить массовую долю висмута в сплаве.
-
Доброго времени суток, господа форумчане! Может кто поможет мне с задачками по аналитической химии, а? Хоть что нибудь, а то категорически не успеваю(((( 1. На титрование 25,00 см3 раствора KCl c TКCl/Ag = 0.01000 г/см3 расходуется 23,20 см3 раствора нитрата серебра неизвестной концентрации. Какова молярная концентрация нитрата серебра? 2. Вычислить потери РbSО4 (в г и %) за счёт растворимости осадка, полученного при добавлении к 20 см3 раствора Рb(NО3)2 молярной концентрацией 0,1 моль/дм3 и полуторного избытка раствора серной кислоты молярной концентрацией 0,1 моль/дм3. 3. Рассчитайте массовую долю Н2SО4 в. навеске 1,0215 г, если на титрование ее идет 20.00 см3 NаОН, молярная концентрация эквивалента которого 0, 1013 моль/дм3. 4. Навеска иодида калия массой 4,3080 г растворена в мерной колбе на 200см3 на титрование 20.00 см3 этого раствора, после обработки окисли¬телем расходуется 23,16 см3 раствора тиосульфата (Т(Na2S2O3/К2Сг2О7 = 0,005348 г/см3). Рассчитать массовую долю КI в образце.
-
- аналитическая химия
- задачи
-
(и ещё 1 )
C тегом:
-
Задача: при какой минимальной концентрации соляной кислоты не будет выделяться осадок CaC2O4 из водного раствора, содержащего 0,01 моль/Л хлорида кальция и 0,1 моль/Л Na2C2O4?
-
- выпадение осадка
- растворимость
- (и ещё 2 )
-
Какую навеску NaOH нужно взять, чтобы на титрование её израсходовать 22,0 мл раствора HCl? T(HCl/Na20)=0,003514 Если можно напишите формулы для расчетов, пожалуйста
-
Молярная концентрация эквивалента серной кислоты равна 1моль/дм3. Какой объём этой кислоты потребуется, чтобы растворить 1г магнезита, содержащего 10 процентов нерастворимых примесей?
-
Как определить массу KOH в контрольном растворе. План работы. Уравнение химической реакции, лежащей в основе определения. Как определить по справочной литературе Моль эквивалент определяемого вещества в кислотно-основном титровании?
-
- кислотно-основное титрование
- аналитическая химия
- (и ещё 1 )
-
Как приготовить 20 % раствор NaCl в объеме 300 мл? 0,1 нормальный раствор H3PO4 в объеме 200 мл? 0,15 М раствор HCl в объеме 150 мл? Как решать эти и подобные им задачи? Пожалуйста, помогите мне. Заранее спасибо.
- 1 ответ
-
- растворы
- аналитическая химия
- (и ещё 3 )
-
Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] - равна 1,4·10- 20
- 2 ответа
-
- аналитика
- аналитическая химия
-
(и ещё 1 )
C тегом:
-
Доброго времени суток. Всем известно, что нельзя обнаружить катионы калия в присутствии катиона аммония. А можно ли обнаружить катион Na+ в присутствии катиона NH4+?
-
Какую навеску руды, содержащую 20% железа, нужно взять для определения железа в виде оксида железа (ІІІ)? Осадок аморфный. Знаю, что тут проще простого, но я что-то туплю. Аморфный осадок меня смущает. Выручайте Так, решать через эту формулу или нет? m(нав)=m(гр.ф)*F*100/C% m(гр.ф)=0,1 (т.к аморфный осадок) F=2M(Fe)/M(Fe2O3)= 2*56/2*56+3*16=0.7 m(нав)=0,35г Правильно?
-
-
- титрование
- аналитика
-
(и ещё 1 )
C тегом:
-
Пробу смеси хлороводородной и фосфорной кислот объемом 5мл разбавили до 200 мл. На титрование 20 мл полученного раствора с метиловым оранжевым израсходовали 18,2 мл 0,1012 М naoh; при титровании той же пробы с фенолфталеином израсходовали 34,7мл раствора naoh. Какая масса hcl и h3po4 содержалась в 100 мл смеси?
-
Помогите решить 5 нижних задач, после остальных уже качан не варит Начиная с "чему равен Ph раствора.." и до самого низа
-
Бесплатные или недорогие конференции - химия, экология
hurrem опубликовал тема в Выставки и конференции
Если кто располагает информацией о ближайших бесплатных (или если платных, то в разумных ценовых пределах) конференциях, предлагаю ею поделиться http://konferencija-ni.sibscience.ru Уже участвовала в их конференции, публикация правда платная, но сумма невелика и себя вполне окупает – сборник оперативно выкладывают, статьи индексируются в РИНЦ, еще и место какое-то занять возможно. Ближайшее мероприятие – 25-26 мая http://to-future.ru/konferencii/fi/about- 1 ответ
-
- охрана окружающей среды
- очистка сточных вод
- (и ещё 3 )
-
аналитическая химия Качественный анализ, решение смеси.
cvetochek0101 опубликовал тема в Аналитическая химия
Решить качественную смесь Hg2(NO3)2, CaCl2, AgNO3, (NH4)2C2O4, BiPO4, HCl(избыток) 1. Ag+ + Cl- = AgCl ! AgCl! + 2NH4+=[Ag(NH3)2Cl] Ag+ + PO4 3- = Ag3PO4 ! Ca2+ + PO4 3- = Ca3(PO4)2! Cu2+ + 4 NH4+= [Cu(NH3)4]2+ Hg2 2+ + 2Cl- = Hg2Cl2! Hg2Cl2 + NH4+= Hg0 + HgClNH2! ос-к: Hg0, Ag3PO4, Ca3PO4, BiPO4 / раствор: [Cu(NH3)4]2+, [Ag(NH3)2](Cl) + HNO3 Подскажите пожалуйста, не пропустила ли чего? и как поступать далее с осадками и раствором? СПАСИБО!) -
- помощь
- качественный анализ
-
(и ещё 1 )
C тегом:
-
В мерные колбы вместимостью 50 см3 помещают 0; 0,2; 0,5; 1,0; 1,5; 2,0 и 2,5 см3 рабочего градуировочного раствора , что соответствует 0; 2; 5; 10; 15; 20 и 25 мкг определяемого иона или в расчете на 25 см3 анализируемой пробы 0; 0,08; 0,20; 0,4 0,60; О80; 1,0_мг/дм3 опред иона. вопрос: почему при разбавлении нужно делить исходную конц на объем конечный?
-
Здравствуйте. Имеются две задачи: Не прошу у вас решения, подскажите, пожалуйста, какие разделы необходимо изучить, или хотя бы формулы/законы по которым следует решать подобные задачи. Весь гугл перерыл на предмет нахождения в сети подобных типовых задач. Находились всякие, разные, эквиваленты не эквиваленты, но чтобы по их подобию или с их помощьью решить выше приведенные, особенно вторую, задачи - таких не было =(
- 1 ответ
-
- аналитическая химия
- титрование
-
(и ещё 1 )
C тегом: