-
Постов
1451 -
Зарегистрирован
-
Посещение
-
Победитель дней
2
Тип контента
Профили
Форумы
События
Сообщения, опубликованные SupFanat
-
-
Обычно цинк восстанавливают из его оксида углеродом:
ZnO+C→Zn+CO
Но увы, в этой реакции образуется очень ядовитый угарный газ CO.
Можно ли получить цинк при прокаливании смеси оксида цинка с порошком железа? Например:
ZnO+Fe→Zn+FeO
4ZnO+3Fe→4Zn+Fe3O4
4ZnO+2Fe→3Zn+ZnFe2O4
-
Кто-нибудь знает?
-
Очень многие из нас используют портативные устройства. Всем известно что их аккумуляторы так и норовят сесть в самый неподходящий момент. И тут вспоминается столь нелюбимое экологам углеводородное топливо, литр которого при окислении до углекислого газа и воды дал бы около 30 мегаджоулей (8,3 киловатт-часов) энергии. Так ли много один литр топлива для энергии многократно превышающую энергию полностью заряженного автомобильного аккумулятора?
Но топливные элементы расчитаны на водород (очень неудобный для хранения газ из-за чрезвычайно низкой плотности) или метанол (очень ядовитая жидкость с запахом обычного этанола). А нужны топливные элементы сжигающие пропано-бутановую смесь. Сделают ли такие скоро и не очень дорого?
-
Можно ли либо превратить метанол в этанол и воду либо получить этанол из смеси, из которой обычно получают метанол:
2CH3OH→C2H5OH+H2O
2CO+4H2→C2H5OH+H2O
а потом ещё изобрести этанолово-воздушный топливный элемент?
Цель - замена метаноловых топливных элементов на этаноловые без замены сырья синтез-газ (смесь CO и H2)
-
Я знаю что нагревание только формиата натрия даст оксалат натрия и водород:
2HCOONa → Na2C2O4 + H2
Но мне кажется что здесь есть риск выделения угарного газа при перегреве:
Na2C2O4→ Na2CO3 + CO
Если нет, но нагревать просто формиат натрия для получения водорода лучше - он не такой едкий как его смесь с очень едким гидроксидом натрия.
-
Мне изветсно обобщённое уравнение реакции натриевых солей одноосновных карбоновых кислот с гидроксидом натрия при сплавлении:
RCOONa + NaOH → Na2CO3 + RH
Подставив R=H (соль формиат натрия) получим уравнение реакции:
HCOONa + NaOH → Na2CO3 + H2
Получится ли так на самом деле?
-
Просьба не считать эту тему копией темы "Угарный газ + вода -> муравьиная кислота?". Там обсуждалось только связывание угарного газа в формиаты. А здесь более общая тема.
Итак, угарный газ очень ядовит. И устройство для удаления его из воздуха было бы очень полезно.
Насколько мне известно, угарный газ при комнатной температуре нестабилен к окислению кислородом до углекислого газа (2CO+O2=2CO2), к дисмутации на углекислый газ и углерод (2CO=C+CO2). Надеюсь что он нестабилен и к гидратации до муравьиной кислоты (CO+H2O=HCOOH). Хотелось бы любым из этих методов (в том числе и третьим, если он возможен) связать угарный газ так чтобы остаточная концентрация не превышала ПДК в атмосферном воздухе. Желательно очень быстро. (Первый способ неинтересен тем что я не люблю окисление с рассеиванием энергии (говорят гопкалитовые противогазы очень неудобны из-за выделения тепла при окислении CO), а второй - оседанием частиц углерода на катализаторе). Третий смотрится наиболее интересным.
-
Как провести реакцию CO + H2O = HCOOH ?
Две реакции NaOH + CO = HCOONa и затем 2HCOONa + H2SO4 = 2HCOOH + Na2SO4 не устраивают расходом гидроксида натрия и серной кислоты на получение сульфата натрия и воды.
Цель - уничтожение отходов угарного газа. Было бы очень удобно - очень ядовитый угарный газ с безвредной водой давал бы раствор кислоты, который хоть и опасен в высоких концентрациях, но куда менее чем угарный газ. Если бы реакция произошла при комнатной температуре до конца - было бы просто идеально. "Мешает угарный газ? Просто добавь воды."
Другой вариант - снимаем требование использования только воды. Пусть угарный газ связывает раствор щёлочи. Всё равно муравьная кислота не нужна. Нужно только дешёвое связывание угарного газа. Можно ли сделать каталитическое связывание угарного газа раствором щёлочи, но так чтобы связывался не газ под давлением много атмосфер, а даже следы газа (остаточная концентрация должна быть ниже ПДК угарного газа в атмосферном воздухе)?
-
Как провести реакцию CO + H2O = HCOOH ?
Две реакции NaOH + CO = HCOONa и затем 2HCOONa + H2SO4 = 2HCOOH + Na2SO4 не устраивают расходом гидроксида натрия и серной кислоты на получение сульфата натрия и воды.
Цель - уничтожение отходов угарного газа. Было бы очень удобно - очень ядовитый угарный газ с безвредной водой давал бы раствор кислоты, который хоть и опасен в высоких концентрациях, но куда менее чем угарный газ. Если бы реакция произошла при комнатной температуре до конца - было бы просто идеально. "Мешает угарный газ? Просто добавь воды."
-
У меня есть "железное волокно" (по-немецки Eisenwolle) - обычное и сожжённое на воздухе.
Теоретически интересно как восстановить сожжённое железо (оксиды железа) до металлического железа.
Намного ли лучше идёт реакция с метаном? С водородом? С угарным газом?
-
Насколько полным будет восстановление оксидов железа? И главное окисление пропана и бутана? Не хотелось бы чтобы получался угарный газ.
-
Можно ли получить из этой смеси металлический алюминий?
-
Здесь предлагается использовать графитовые аноды. Я же сказал что мне это не нравится.
-
Извините за трёхкратной создание одной темы. Я видел дважды сообщение об ошибке и повторял создание темы.
-
Как провести электролиз расплава оксида бора?
Это вещество привлекает легкоплавкостью (температура плавления всего лишь 450 °C, точно не проверял, но на уже газовой плите вещество плавится), меньшей химической активностью (а значит огне- и взрывоопасностью) получаемого бора по сравнению со щелочными или щёлочноземельными металлами (охлаждённый до комнатной температуры бор не реагирует с водой!). Чтобы получить оксид бора достаточно прокалить борную кислоту.
Непонятно из какого материала должна быть сделана посуда для плавления оксида бора. Должна ли сама ёмкость служить катодом (и соответственно быть сделаной из электропроводника) или нужна ёмкость из электроизолятора и два подвешенных электрода? Какие инертные аноды можно использовать (не хочу быстро сгорающих при электролизе угольных анодов)? Какое нужно напряжение? Нужны ли какие-то добавки для повышения электропроводности расплава?
-
-
Я читал что эти соединения (соли с анионом MnO43-) синего цвета. Но как их получить? В отличие от манганатов (VI) и манганатов (VII)=перманганатов это нигде не написано.
Пишут что эти соединения крайне неустойчивы. Есть ли исключения? Мне кажется что Li+3MnO43-, La3+MnO43- могут быть достаточно устойчивыми и получаемыми сплавлением Li2O или La2O3 c MnO2 на воздухе (или в кислороде).
-
Насколько прочно стекло связывает оксид бора B2O3?
-
Проводил ли кто-нибудь такой эксперимент? При каких условиях? Что при этом получалось?
-
Нашёл гидроксид кальция Ca(OH)2 и борную кислоту H3BO3, смешал их водные растворы - выпал белый кристаллический осадок. Но про бораты кальция почти нигде ничего не пишут.
Имеют ли они хоть какие-то применения?
-
Неужели никто с этого форума ни разу не проводил эксперимент: прокаливание смеси порошков железа Fe и оксида цинка ZnO, конденсация образующихся (если они конечно образуются) паров цинка Zn?
-
-
Что будет если сильно прокалить смесь порошков оксида цинка ZnO и железа Fe?
Возможно ли хотя бы в ничтожной степени провести реакцию например ZnO+Fe=Zn↑+FeO? Или 4ZnO+2Fe=Zn[Fe2O4]+3Zn↑.
-
При какой температуре оксид бора (обезвоженная борная кислота) растворяется в стекле, давая боросиликатное стекло?
Или для этого надо брать тетраборат натрия (бура, Na2B4O7)?

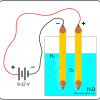
Получение натрия прокаливанием смеси хлорида натрия и карбида кальция?
в Неорганическая химия
Опубликовано
Что получится при прокаливании смеси NaCl и CaC2?
Хорошо бы провести такую химическую реакцию:
2NaCl+CaC2→2Na↑+CaCl2+2C
Это лучше другой реакции
Na2CO3+2C→2Na↑+3CO↑
отсутствием необходимости отделять натрий от угарного газа - хлорид кальция и углерод в отличие от монооксида углерода нелетучие вещества.