-
Постов
10617 -
Зарегистрирован
-
Посещение
-
Победитель дней
47
Тип контента
Профили
Форумы
События
Весь контент M_GM
-
Видимо ошибка в условии - либо в задачнике, либо при переписывании Реакция соединения всегда сопровождается увеличением молекулярной массы, а здесь она уменьшилась с 9 до 6 - так не бывает.
-
Добавляя эти удобрения, вы одновременно добавляете азот в количествах: 1) Для Калия мы добавляем "Калий Азотнокислый" - KNO3 + азот: 10,8 2) Для фосфора мы добавляем "Моноаммонийфосфат" - NH4H2PO4 + азот: 1,8 3) Для кальция мы добавляем "Нитрат Кальция 2-водный" - Са(NО3)2 x 2Н2О + азот: 14 ====================================================================== Всего добавлено азота 26,6 Т.е. в вашей смеси уже есть небольшой избыток азота по сравнению с требуемым (20:4:30:20:5) который, я думаю, не помешает, но ничего добавлять не нужно.
-
Сила окислителя, характеризуемая окислительно-восстановительным потенциалом, зависит от его концентрации. При низкой концентрации она может стать недостаточной для протекания реакции окисления. Так для окисления железа до +2 достаточно, чтобы потенциал окислителя был больше -0,44В, для перевода железа +2 в +3 необходим уже потенциал больше +0,77В. Стандартный потенциал нитрат-иона равен 0,96В, но это относится к кислоте 1 моль/л, т.е. примерно 6%-ному раствору.
- 1 ответ
-
- 1
-

-
А парциальные давления не нужно считать - они даны в пункте Б) - для некого исходного состояния смеси.
-
Парциальное давление вещества в газовой смеси определяется по формуле: р(А)=Р(общ)*x(A) где x(A) - мольная доля вещества А в газовой смеси. Отсюда: x(A) = р(А)/Р(общ) По этой формуле и рассчитываются мольные доли веществ в вашей задаче.
-
В) Смесь описанная в пункте Б) имеет общее давление равное 1,51 атм, с мольными долями веществ: СOCl2: 1/1,51 = 0,662, Cl2: 0,01/1,51 = 0,00662, и CO: 0,5/1,51=0,331 Рассмотрим 1 моль смеси Пусть при достижении хим. равновесия количество вещества хлора изменилось на х моль. Соответственно изменятся и мольные количества других веществ, они станут равны: СOCl2: 0,662-х, Cl2: 0,00662+х, и CO: 0,331 + х Общее количество вещества смеси тоже изменится и станет равно 1+х моль, что приведет к изменению общего давления, оно станет равно 1,51(1+х) Мольные доли газов в равновесной смеси будут равны: СOCl2: (0,662-х)/(1+х), Cl2: (0,00662+х)/(1+х), и CO: (0,331 + х)/(1+х) Парциальные давления газов в смеси будут равны (общее давление умножаем на мольную долю) СOCl2: 1,51(0,662-х); Cl2: 1,51(0,00662+х), и CO: 1,51(0,331 + х) Подставляя эти давления в выражение для константы (значение которой известно из пункта А), К= 1,51(0,00662+х)(0,331 + х)/(0,662-х) получаем уравнение с одним неизвестным, найдя которое найдем и парциальное давление хлора.
-
Определенная порция газа (моль), при определенных условиях (р, Т) занимает вполне определенный объем. Его можно измерить, хотя бы по вытеснению определенного объема воды. - Нет, вы конечно можете засунуть эту порцию газа в другой объем, и газ там разместится - но при этом условия его существования (прежде всего давление) неизбежно изменятся. В формулировке закона отмечается, что объемы газов сравниваются при одинаковых условиях, т.е. при одинаковой температуре и одинаковом давлении.
-
Если степень превращения равна 30%, то в равновесной смеси (для 1 моль исходного вещества) будет находиться 0,3 моль PCl3, 0,3 моль Cl2 и 0,7 моль PCl5, общее количество вещества станет равным 1,3 моль Если общее давление равно Х, то парциальное давление PCl3 и Cl2 будет равно 0,3х/1,3 = 0,231х Парциальное давление PCl5 будет равно 0,538х. Вот это и надо использовать в константе: 2,75=(0,231х)^2/0,538х Правильно ли посчитана константа не проверял
- 2 ответа
-
- 1
-

-
Ну что, с ответом все в порядке. Если использовать исправленное значение константы и аккуратно работать дальше, к такому ответу и придем.
-
Во-от! Ты оказывается и ответ знаешь, но скрываешь! Давай делись! Впрочем и в ответах бывают ошибки/опечатки ...
-
Неверно. сколько моль каждого вещества будет в системе в момент равновесия? Если "При смешении по 0,5 моль 100%-х этанола и уксусной кислоты выход реакции этерификации составил 40%." ?? Тебе не кажется, что реагенты должны расходоваться при образовании продуктов?
-
Стоило бы написать, что нашли и сколько. Вторая часть задачи - алгебраический метод. Пусть для реакции взяли 1 моль уксусной кислоты и х моль спирта, при этом в реакцию вступило 20% спирта, т.е 0,2х моль. Используя это выражаем через х равновесные количества вещества всех участников системы, подставляем в выражение для константы и приравниваем к ее значению, которое, надеюсь вы нашли. Имеем уравнение с одним неизвестным х, находим количество вещества (моль) спирта, а затем и его массу. Всё !!!
-
Откуда эти циферки? 0,2? 0,5? Что такое Kp? Константа равновесия Kp (читается "Ка пэ") это константа равновесия выраженная через парциальные давления участников реакции (р) и применяется для газовых реакций. К данной задаче не имеет никакого отношения. Единственная константа, которую можно найти в данной задаче это Кх - константа равновесия выраженная через мольные доли участников реакции (х) в состоянии равновесия (читается "Ка икс"). Поэтому первое, с чего следует начать, это найти равновесные мольные доли участников реакции, для этого найти сколько моль каждого вещества будет в системе в момент равновесия. Напомню, что мольная доля считается по формуле х(А) = n(A)/∑(n)
-
Следует обратить внимание и на химию задачи. Известно, что гидроксид алюминия - амфотерен. Согласно вашим расчетом в растворе остается большой избыток щелочи, гидроксида бария. К чему это приведет?
-
Прежде чем находить Кр надо найти мольную долю каждого участника реакции и его парциальное давление. А Кр выражается через парциальные давления также, как Кс через равновесные концентрации.
-
Есть объём, температура, давление - вспоминай газовые законы и считай общее количество вещества в системе при этих условиях, думай, как оно получилось из 1 моль Н2S, находи мольные доли, парц. давления и, ура! ==> Kp
-
При выполнении подобных заданий надо знать, что термохимические уравнения можно складывать, вычитать, умножать на некоторые коэффициенты. При этом также складываются, вычитаются, умножаются на те же коэффициенты и значения тепловых эффектов или ΔH в этих уравнениях. №1 Напишем уравнение реакции, которое нужно получить, и ΔH которой нужно определить: С2H2 (г) + H2 (г) = C2H4 (г); ΔHх = ??? Смотрим, какие уравнения нам даны, откуда взять вещества для нужной реакции. Ацетилен есть в первом уравнении, но его там в два раза больше чем нужно! Что делать? Взять первое уравнение, но умножить его на коэффициент 0,5: 0,5 | 2С2H2 (г) + 5O2 (г) = 4CO2 (г) + 2H2O (г) ΔH1 = -2510 кДж | После умножения будем иметь: | С2H2 (г) + 2,5O2 (г) = 2CO2 (г) + H2O (г) 0,5ΔH1 = -1255 кДж | С чем реагирует ацетилен? С водородом! Водород есть в уравнении 3, но его там тоже вдвое больше! Значит, и третье уравнение надо умножить на 0,5: 0,5 | 2С2H2 (г) + 5O2 (г) = 4CO2 (г) + 2H2O (г) ΔH1 = -2510 кДж 0,5 | 2H2 (г) + O2 (г) = 2H2O (г) ΔH3 = -484 кДж | После умножения будем иметь: | С2H2 (г) + 2,5O2 (г) = 2CO2 (г) + H2O (г) 0,5ΔH1 = -1255 кДж | H2 (г) + 0,5O2(г) = H2O (г) 0,5ΔH3 = -242 кДж | В продуктах нашей реакции мы должны получить этилен, C2H4. Этилен есть в уравнении 2, но он в исходных веществах ? Чтобы перенести его вправо, надо всё уравнение умножить на -1: 0,5 | 2С2H2 (г) + 5O2 (г) = 4CO2 (г) + 2H2O (г) ΔH1 = -2510 кДж 0,5 | 2H2 (г) + O2 (г) = 2H2O (г) ΔH3 = -484 кДж -1 | C2H4 (г) + 3O2 (г) = 2CO2 (г) + 2H2O (2) ΔH2 = -1322 кДж После умножения будем иметь: | С2H2 (г) + 2,5O2 (г) = 2CO2 (г) + H2O (г) 0,5ΔH1 = -1255 кДж | H2 (г) + 0,5O2(г) = H2O (г) 0,5ΔH3 = -242 кДж | 2CO2 (г) + 2H2O = C2H4 (г) + 3O2 (г) -ΔH2 = +1322 кДж ====================================================== Складываем результаты умножения: С2H2 (г)+2,5O2(г)+H2 (г)+0,5O2(г)+2CO2(г)+2H2O= = C2H4 (г) + 3O2 (г)+2CO2(г)+H2O(г)+H2O(г); ΔHх = 0,5ΔH1 + 0,5ΔH3 -ΔH2= Нетрудно видеть, что все попутные формулы веществ сокращаются (если не так, значит в предыдущих умножениях и пр. были допущены ошибки, проверяем!) После приведения подобных и сокращения имеем: С2H2 (г)+ H2 (г) = C2H4 (г) ; ΔHх = 0,5ΔH1 + 0,5ΔH3 -ΔH2 = -1255-242+1322 = -175 кДж Добавлю, что если вопрос звучит именно так: "Вычислите тепловой эффект", я бы написал Q = -ΔHх = +175 кДж (экзотермическая реакция) Вторая задача решается аналогично.
-
И с чем по твоему он будет взаимодействовать? Предложи уравнение реакции.
-
В ионных уравнениях в виде ионов записывают только сильные электролиты. Значит, для реакции ты должен взять сильную кислоту и сильное основание (H+ + OH-) Слабые электролиты, осадки, газы записываются в виде молекул Таких молекул, кроме Н2О в уравнении нет. Значит в ходе нужной реакции ни осадков ни газов не образуется. Остаётся выбрать нужное
-
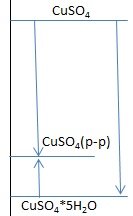
Да нет, это ты что-то путаешь. Направления стрелок имеют значение. Можно еще следствие из закона Гесса использовать Из безводного CuSO4 получить раствор можно двумя путями (по стрелочкам) - сразу растворить (Q1) или - сначала превратить в кристаллогидрат (Q3), а затем этот кристаллогидрат растворить (Q2). Согласно следствию из закона Гесса, тепловой эффект не зависит от пути процесса, значит Q1 = Q3 + Q2, или в итоге Q3 = Q1- Q2 где Q1 = 66,5 кДж; Q2 = -11,93 кДж.
-
Нет можно использовать и т-х. уравнения, только писать их правильно Растворение безв. соли: 1) CuSO4(тв.) + (n+5)H2O =CuSO4(р-р) + Q1 Растворение кристаллогидрата: 2) CuSO4•5H2O(тв.) + nH2O =CuSO4(р-р) + Q2 Процесс гидратации CuSO4(тв.)+5H2O=CuSO4•5H2O(тв.) можно получить если из уравнения 1 вычесть уравнение 2: CuSO4(тв.)+5H2O=CuSO4•5H2O(тв.) + Q1-Q2 Откуда Q3 = Q1- Q2 где Q1 = 66,5 кДж; Q2 = - 11,93 кДж.
-
Энергетическая диаграмма подскажет. Постарайся на ней изобразить энергию безводной соли, кристаллогидрата и раствора, нарисовать стрелки, изображающие процессы растворения, гидратации, использовать законы сохранения.