Поиск
Показаны результаты для тегов 'анод'.
Найдено 12 результатов
-
Цитирую из одной статьи в Дзене: "По большому счету картофелина исполняет роль контейнера для электролита (кислотно-солевой раствор), который содержится в ней. Втыкая два электрода (медный и цинковый (или стальной)), мы запускаем окислительно - восстановительную реакцию на поверхности анода (где формируется кислая среда) в результате которой: На аноде (цинк-восстановитель) происходит процесс выделения свободных электронов, а на катоде (медь-окислитель) происходит процесс поглощения свободных электронов." Непонятным для меня осталось следующее: как анод может "выделять" электроны, если окислителю положено их поглощать? А как катод может поглощать? Или я туплю, или тупонул автор статьи, я просто новичок в этой науке и пока неуверен в себе чтобы делать чёткие выводы. Таки цинк это анод или катод? Далее, цитирую из двух Википедий (одна русская, другая английская с переводом): "Водоро́дный показа́тель — мера кислотности водных растворов. Является способом выражения активности катионов водорода в растворах. В химии показатель pH также называется кислотностью или щелочностью и исторически означает "потенциал водорода" (или "сила водорода"). Кислотные растворы (растворы с более высокой концентрацией водорода (H+) ионов) имеют более низкие значения pH, чем основные или щелочные растворы." Итак, я не понял вот чего: если водородный показатель - это способ выражения активности катионов водорода (H+), и растворы с более высокой концентрацией H+ имеют кислую среду, то почему по шкале от 0 до 14 концентрация катионов водорода определяется нижними числами, а не верхними? Больше число - больше концентрации, разве нет? Мы ведь говорим о pH, а не о pOH, верно? Значит если в водном растворе высока концентрация катионов водорода (водород силён), то показатель водорода этого раствора должен быть выше (больше числом) нейтрального значения. Не в химическом смысле, а в логическом, математическом, числовом. Короче я не пытаюсь изменить эту часть науки, формулу, мне лишь непонятна логика того, почему силу концентрации выражают меньшим числом, а не большим. Я ошибся или эта странность имеет место быть? Заранее благодарю за ответы!
-
Решить задачу в рабочей тетради. При электролизе 400г 30% р-ра гидроксида натрия на катоде выделилось 5,6л (н.у) газа. Найти массовую долю оставшегося в-ва в электролизере и объем газа (н.у.)
- 7 ответов
-
- электролиз
- naoh
-
(и ещё 5 )
C тегом:
-
Добрый день всем. Помогите пожалуйста решить 1151 задачу(фото прилагается). Как я понял покрытие катодное, с написанием уравнений у меня беда. А с ЭДС я не до конца понял, вроде разность потенциалов нужна, а вроде, раз есть активность ионов, то нужно использовать уравнение Нернста. Хотя я скорее всего что-то напутал)
-
Составить электрохимические схемы двух гальванических элементов: в первом никелевый электрод является катодом, а во втором - анодом. Рассчитать ЭДС этих элементов в стандартных условиях.
-
Добрый вечер. Помогите с решением: Составить уравнение анодных и катодных процессов, протекающих при коррозии Sn-Pb сплава в растворе хлорида натрия при контакте с воздухом. Предложить анодное и катодное покрытие для сплава. Какие процессы будут иметь место при коррозии данного сплава в случае нарушения сплошности анодного покрытия? Хотя бы скажите, что делать с хлоридом натрия?
-
Какой металл можно использовать для электролиза, чтобы он не растворялся, Такой, который можно найти дома или на улице?
- 16 ответов
-
- 1
-

-
- электролиз
- анод
-
(и ещё 2 )
C тегом:
-
Составьте уравнения электродных реакций, протекающих при электролизе с нерастворимым анодом водного раствора СoCl3. Рассчитай массу вещества, выделившегося на катоде при пропускании тока силой 5А в течении 30 минут. Вторую часть задачи я решил, я вот со второй проблемой. CoCl3 + H2O = CoOHCl2 + HCl -правильно ли это? и какими тогда будут уравнения на электродах? Заранее спасибо за помощь
-
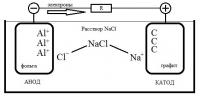
Заранее извиняюсь, я не химик по профессии, так что не будьте строги. Я тут заинтересовался самодельными батарейками. И занялся конструированием самой простой с солевым раствором в качестве электролита. Меня интересует какие химические продукты выделяющиеся в гальваническом элементе состоящим из соляного раствора NaCl•H2O и электродов из алюминия (фольга) и графита. Могу предположить следующее: 1.Натрий оседает на катоде (углероде, точнее графите) и не вступает с ним в реакцию. Хлор также оседает, но на аноде (алюминий, в моем случае фольга) и не вступает с ним в реакцию. 2. Либо... Далее натрий осевший на катоде реагирует с водой: 4Na + O2 +2H2O = 4NaOH И щелочь NaOH реагирует с алюминием (что мне кажется маловероятно): 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑ Или хлором, который осел на катод (что мне кажется более вероятным): 2NaOH + Cl2 = NaClO + NaCl + H2O А хлор, частично, вступает в реакцию с алюминием и в результате AlCl3 выпадает в осадок. И далее, AlCl3 реагирует со щелочью: AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl Мой элемент длительное время способен выдавать напряжение в 0.3 вольта, но если периодически протирать графит, то напряжение возрастает примерно в двое, до 0.6 вольт, но очень скоро падает до 0.5. А через час, после протирания, падает до 0.3 вольт. Правда это все без нагрузки (если не считать сопротивление старенького вольтметра). При том, что если протирать фольгу, то особого подъема напряжения я не заметил. Далее, я заметил, что можно и не протирать катод, а сделать два катода соединенного одним проводом.При этом в то время как первый катод находится в растворе, второй сушится на воздухе. Когда напряжение падает до 0.3 то, если их поменять местами, вижу, что напряжение возрастает до 0.5, но в течении пары минут падает до 0.4. И если каждый раз так менять катоды с периодом в семь минут, то напряжение меньше 0.35 вольт не упадет. Я так подумал, а что если катодов будет не два а пять, к примеру, то время смены можно уменьшить, а среднее напряжение возрастет. Про это я сумел найти только то, что при прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. С тем же эффектом можно второй катод и не вынимать из раствора, а лишь провод коннектить то с одним, то с другим катодом... То есть если сделать некий электронный прерыватель работающий на той же батарейке которую он и регулирует, который переключатся между катодами, то напряжение можно усреднить и до 0.5 вольт. Я не физик, и не так хорошо знаком с электроникой, но мне кажется это очень интересным Итак, мои вопросы: 1. Почему так происходит с двумя катодами? 2. Какие все же реакции протекают в таком элементе?
-
1) Используя таблицу стандартных электродных потенциалов в водных растворах при 25^о C, написать формулу Нернста для равновесного потенциала электродов на базе следующей полуреакции: MnO2 + 4H^(+) + 2e = Mn^(2+) + 2H2O 2) Два разных металла (Zn - Cr) погружены в 0,01 М растворы своих солей. Для каждой электрохимической цепи (гальванического элемента) выписать потенциалообразующие полуреакции, написать формулу Нернста для равновесного скачка потенциала, определить катод и анод, написать процессы на электродах при работе гальванического элемента, составить токообразующую реакцию элемента, вычислить ЭДС. 3) Как должен быть составлен элемент, чтобы в нем протекала реакция: H2 + Cl2 = 2HCl
- 1 ответ
-
- эдс
- электродный потенциал
-
(и ещё 3 )
C тегом:
-
Добрый вечер, нужна помощь Составить схемы электролиза:а) расплава FeBr2 б)Водного раствора Na2S с угольным анодом в) водного раствора Cu(NO3)2 с графитовым анодом
- 3 ответа
-
- Электролиз
- расплав
-
(и ещё 2 )
C тегом:
-
Для уравнения реакции Ca(OH)2 + H2CrO4 = CaCrO4 +2H2O запишите строение мицеллы, гранула которой будет двигаться к аноду.
- 1 ответ
-
- Коллоидные растворы
- Свойства
- (и ещё 7 )
-
Через раствор MnSo4, с концентрацией 1 М пропустили ток силой 10 А в течение 22 минут. Определите массовую долю марганца, выделившегося при электролизе из раствора. Напишите уравнение анодного и катодного процессов. Что может применяться в качестве анода и катода?
- 3 ответа
-
- электролиз
- анод
-
(и ещё 5 )
C тегом: