Поиск
Показаны результаты для тегов 'неорганика'.
Найдено 66 результатов
-
Привет, друзья! Мне нужна очень крутая и информационно насыщенная книга кроме: Ахметова Некрасова Третьякова Алексеева Гринвуд нормальный? или есть кандидаты получше???_ Спасибо всем заранее!;)
- 2 ответа
-
- гринвуд
- неорганика
-
(и ещё 1 )
C тегом:
-
Здравствуйте, объясните, пожалуйста, почему в этой задаче нельзя взять H3PO4 вместо K3PO4? (Правильный ответ 24)
-
Необходим химик-технолог для доработки рецептуры химической смеси для беспламенного нагревателя пищи. На данный момент есть три рецепта, необходим подбор оптимального по весу и себестоимости. Также необходимо прописать химическую реакцию. Все вопросы и предложения можно обсудить в л/с. Спасибо за внимание!
-
- работа
- неорганика
-
(и ещё 1 )
C тегом:
-
Элетролиз солей карбоновых кислот. Р-ция Кольбе.
30JL0TOu_XuMuK опубликовал тема в Неорганическая химия
Добрый вечер, у меня завалался очень концентрированный раствор ацетата натрия (процесс кристаллизации уже идёт по-немногу). Хочу провести синтез Кольбе и в результате получить едкий натр. Электроды из какого легкодоступного металла или неметалла можно использовать для большей эффективности? И разбавить ли мне раствор, опять же для большей эффективности?- 5 ответов
-
- синтез
- неорганика
-
(и ещё 1 )
C тегом:
-
Помогите пожалуйста с реакцией
- 6 ответов
-
- неорганика
- неорган химия
-
(и ещё 1 )
C тегом:
-
Здравствуйте! Помогите, пожалуйста, с решением такой задачи (необходимо определить металл M и соединения A-D): Я рассуждаю так, что A - это N2O4 в полярном растворителе (этилацетат) диссоциирует гетеролитически с образованием NO2+ и NO2-, поэтому комплекс A будет иметь вид (NO2)n-x[M(NO2)n] (x - валентность металла, n > x по условию). При нагревании A происходит изменение КЧ металла и отщепление нескольких молекул NO2. Пусть отщепляется m моль NO2 на 1 моль A, тогда по условию молярная масса A равна 46m/0.58 = 79.3m. Перебирая значения m (1, 2, 3...), получаем молярную масса A, но вычитая целое число молярных масс NO2, не получаем адекватных значений молярной массы металла. Из соотношения потерь масс на различных стадиях также ничего получить мне не удалось. Может у кого-то есть какие-то идеи?
-
Добрый вечер. Ни как не могу найти нужный ответ на вопрос. Может ли в состав продукта из полимера входить органическое пищевое масло как ухаживающий компонент?! Например: Продукт для депиляции (удаление волос) - полимер с маслом софлоры, или с касторовым маслом.... Если такого не может быть, можете объяснить почему?!
-
Недавно набрел и заинтересовался вот этой свежей публикацией. https://link.springer.com/article/10.1007%2Fs00214-019-2524-0 Тут говорится, что молекулы большинства гипервалентных гидридов галогенов должны существовать и что первыми кандидатами для наблюдения являются IH3 и IH5. А кто-то вообще пытался получить такие соединения?
- 5 ответов
-
- неорганика
- кванты
- (и ещё 2 )
-
457.Рассчитать массу и объем продуктов реакции, если прореагировало 0.5 моль эквивалентов О2 при н.у 4NH3+5O2=4NO+6H2O
-
Здравствуйте! При решении задачи столкнулась с неточностью в ответе. В решении, указанном составителями сборника, в ответе не учитывается концентрация HNO3, хотя при расчёте массы раствора массу азотной кислоты не вычли. То есть в растворе она есть, но её массовую долю не находят. Можете ли объяснить, почему? Или же это просто неточность или опечатка? Заранее благодарю за помощь. Прикрепляю условия задачи и решение:
- 1 ответ
-
- егэ
- егэ по химии
- (и ещё 7 )
-
Формула соединения CaXO4, где X - неизвестный элемент. w(X) = 0.6389 Также известно, что он реагирует с раствором кальцинированной соды, в результате чего образуется белый осадок. Заранее спасибо
-
Помогите пожалуйста. Начала делать цепочку. Что в первой реакции получается понятно. А вот дальше... С чем из H2O, NO2 и Cu(NO3)2 будет реагировать NO?
-
H2O2+CuSO4 Что это за бред и кому пришло в голову.
Loiso Pondohva опубликовал тема в Неорганическая химия
О взываю о помощи. Сидел я недавно в деревне, почти без реактивов. Делать было нечего и тут в голову пришла шальная мысль. А что бы к купоросу не прилить перекиси 5%. Ну так. Чисто в порядке бреда. Что я ожидал. H2O2 выступит как слабенькое основание. Получится атомарный кислород, серная кислота и медь. Атомарный кислород мгновенно окисляет медь, получаем чёрный оксид меди на донышке и серную кислоту и водичку(Эх фааантазёр!). Ну вот. Смешал. Чуть подогрел. Сначала 0 реакции... Потом раствор и резко сильно почернел. Осадок не выпал. Индикаторная бумажка показала чуть кислую среду. Почти незаметную. Время шло. Оттуда идут пузырьки газа. Кажется он горит, но я не ручаюсь. Запаха нет. Ещё спустя 3 минуты я разглядел, что раствор и не особо чёрный, а цвета хакки. А теперь прошло уже 10 минут и он приятного салатового цвета, пузырьки газа всё идут, а я так и не понял что это. Буду благодарен за наводку.- 3 ответа
-
- неорганика
- пероксид водорода
- (и ещё 2 )
-
Здравствуйте,учусь в 9 классе,уровень знаний на без 4 баллов на заключительном этапе всеросса и призер на московской олимпиаде. Прошу посоветовать с чего стоит начать изучать органику. На руках есть 4-х томник Реутова,но чувствую ,что это жестко для начала,так же по чему изучать неорган. Сам учу по Еремину "Начала химии" + почитываю "химия элементов" Гринвуда. Буду безмерно благодарен)))
- 12 ответов
-
- органика
- неорганика
- (и ещё 3 )
-
Al2(SO4)3+Na2CO3+H2О=3CO2+3Na2SO4+2Al(OH)3 проверить, входит ли карбонат алюминия в состав осадка. Для этого подействовали раствором соляной кислоты. Что наблюдается? Сделайте вывод.
- 1 ответ
-
- солей
- неорганика
-
(и ещё 5 )
C тегом:
-
ПОМОГИТЕ ПОЖАЛУЙСТА! Я НЕ ХИМИК, НО ДЛЯ ЗАЧЕТА НАДО(
nonstopnonstop опубликовал тема в Решение заданий
ПОМОГИТЕ ПОЖАЛУЙСТА, ВООБЩЕ ХИМИЮ НЕ ПОНИМАЮ, НО ДЛЯ ЗАЧЕТА НЕОБХОДИМО РЕШИТЬ ЭТИ ЗАДАЧИ((( 1. В продуктах реакции хлора с йодистым водородом обнаружено 35,5 г хлора, а теплота процесса составила 15,86 ккал. Какое количество йодистого водорода вступило в реакцию? 2. Возможно ли горение кальция в атмосфере оксида углерода по реакции Са(к) + СО(г) = СаО(к) + С(к) ?-
- неорганика
- химия
-
(и ещё 3 )
C тегом:
-
2CuSO4+4KI = 2CuI+I2+K2SO4 Казалось бы, обыкновенные два вещества растворимых в воде, при воображаемой реакции ионного обмена, в растворе бы наступило ионное равновесие, а нет, здесь ОВР с медью окислителем и йодом восстановителем (прошу прощения если перепутал окислителя с восстановителем). Не мог бы кто нибудь мне растолковать на привычном для него языке в плане терминологии (я пойму) механизм этой реакции? Что является её инициатором? У меня есть теория, что так как сульфат меди дает в растворе кислую среду вследствие гидролиза, а йодид калия нейтрален, то общая среда раствора при смешивании будет кислая, что и провоцирует данную реакцию. И все же желал бы более профессионального ответа.
-
Помогите, пожалуйста Фосфор, количественно выделенный из ортофосфата кальция массой 31г,окислен пр нагревании раствором объемом 27,9мл (плотность=1,4г/м) с массовой долей HNO3 70%. По окончании реакции к образованному раствору был прилит раствор, объемом 65,3 мл (пл=1,225г/мл) с мaссовой долей NаOH 20%. Определите какие веществ и какой массы содержатся в растворе.
-
- фосфор
- неорганика
- (и ещё 4 )
-
Даны вещества A, B, C, D, E, F учавствуют в следующих реакциях (даны без коэффициентов): A + B = C + D C + E = F A + E = F D + E = B Известно также, что А - металл, B содержит 44.1% этого металла, D - газ, все соединения состоят только из трех хим. элементов, то есть вся задача ограничена тремя элементами
-
Составьте уравнения в соответствии со схемой: А → В → С → D → Е, где 1 - реакция замещения; 2 - реакция соединения; 3 - реакция нейтрализации; 4 - реакция разложения Я практически уверена, что тут должно быть что-то с CO2, но тогда не получается 3я реакция, да и заместить на водород какой-нибудь катион металла в карбонате тоже не могу. Помогите, пожалуйста.
-
Указать, какие вещества могут вступать в реакцию в водной среде
JuliaD опубликовал тема в Решение заданий
Я сделала этот номер, но в некоторых не уверена: 1. Хлорид бария + нитрат калия = реакция не идет 2. Нитрат калия и сульфат хрома (III) = реакция не идет 3. Нитрат меди и сульфат железа (III) = реакция не идет 4. Метасиликат натрия и нитрат кальция = реакция не идет 5. Гидроксид железа (II) + карбонат натрия = реакция не идет 6. Кремниевая кислота + нитрат магния = реакция не идет 7. Фосфорная кислота + нитрат калия = реакция не идет. Верно? И еще подскажите, будет ли вступать в реакцию нейтрализации гидроксид алюминия и сероводородная кислота? -
Добрый день друзья. Озадачился следующим вопросом. Штудировал информацию по нанесению подсмазочных слоев на поверхность металла. В дальнейшем металл идет на холодную штамповку. Наткнулся на вариант выдерживания металла в растворе тетрабората натрия Na2B4O7 · 10H2O. Однако пока не могу найти конкретики. Отсюда вопрос к знатокам)) 1. Какие могут проходить реакции на поверхности черного металла. Концентрация буры 50-70г/л при температуре 80-90 градусов. Непонятно за счет каких соединений создается подсмазочный слой. Буду признателен за любую информацию и предположения.
-
-
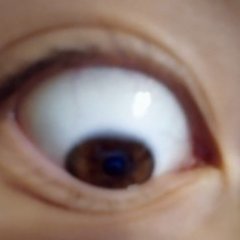
При какой температуре возможны реакции восстановления: Fe2O3(к)+3C(граф)=2Fe(к)+3CO2(г). Возможна ли эта реакция в нормальных условиях?
.thumb.jpg.57673d9b078af8ea6b76813bd85797f0.jpg)