
Nemo_78
-
Постов
8675 -
Зарегистрирован
-
Посещение
-
Победитель дней
40
Тип контента
Профили
Форумы
События
Сообщения, опубликованные Nemo_78
-
-
Без обид, сударь! Очень хотелось бы знать, где ж такие "замысловатые" тесты задают?! Дело в том, что на приведённые вопросы даже как-то не слишком удобно отвечать, ибо не требуется и минимальных знаний по аналитике, только чуток общей эрудиции.
. Попробуйте сами ответить для начала и предложите Ваши варианты ответов, ежели потребуется, Вам помогут и подправят там, где нужно...
С уважением
-
 1
1
-
-
Вычислить молярную концентрацию раствора гидроксида калия имеющего плотность 1,208 г\см³Помогите пожалуйста
. Тремя постами выше Вашего посмотрите, расчётно данную задачу без массовой доли (таблицы плотностей), увы, не решить.
. С уважением
-
. Может быть, но не кажется ли Вам, что для формально строгого решения предельной растворимости исходных солей в данных условиях не хватает?! Ведь с учётом "некислой" растворимости "продуктов" раствор может оказаться пересыщенным, как раз, относительно исходных солей... Или всё, туплю уже, что весьма вероятно (спать пора)?!
. Всё-таки, странная, на мой взгляд, задачка. Достаточно концентрированные растворы сильных электролитов (во втором исходном "рассоле", грубо говоря, на 1 ион меньше трех молекул растворителя приходится), а нас, вроде бы, к банально поверхностному решению подталкивают.
P.S. А, вообще, интересно было бы узнать мнение модераторов и корифеев Форума, не считают ли они целесообразным снабжать задачи и задания со стороны ТС маленькими комментариями насчёт их уровня типа "инженер-теплотехник, 1 курс" или "химия, проф. уровень, 11 класс"? Разумеется, без какой бы то ни было географической привязки, чтобы (не дай Бог) не нарушить конфиденциальности, "а токмо во имя" повышения уровня адекватности подаваемых советов и, в целом, оказываемой помощи. Как в картографии есть понятие "степень генерализации", т.к., согласитесь, точка зрения на один и тот же предмет может сильно разниться в зависимости от уровня наблюдателя. Для кого-то радуга - продукт жизнедеятельности Единорога, для кого-то просто красивое атмосферное явление (зрелище), кто-то же видит в ней банальную дисперсию солнечного света в малых линзах капель воды. Надеюсь, меня правильно поняли...
-
Посоны, суть такова - я растворил садовый железный купорос и прилил к нему р-р хлорида бария, обьем был одинаковый, брал по 75 мл. Ну я думал, что в осадок выпадет чистый сульфат бария, но что то пошло не так, раствор стал мутным, решил профильтровать с помощью фильтровальной "красной" ленты, ничего не изменилось. Что плавает в растворе хлорида железа и как мне его очистить?
Все, понял, каким то образом во время фильтрации сульфат бария попал в раствор, поэтому раствор мутный
. Хоть и давно это было, но остаточная память по гравиметрическому анализу подсказывает, что для фильтрования сульфата бария ввиду его мелкокристалличности предпочтительнее "синяя лента".
. Возможно, использование "неправильного" фильтра является причиной "мутного" фильтрата.
. Хотя, с другой стороны, в этом эксперименте и без этого слишком много недоразумений...
. С уважением
-
1) надо вспомнить (найти в сети, ежели вспоминать нечего) формулки молярной концентрации и массовой доли;
2) посмотреть на них и увидеть, что уже имеется в условии, а чего не хватает. Не хватать там может конкретных вещей: в первом случае количества растворенного вещества, а во втором - массы раствора. Но это же для серьёзных химиков не проблема: а) химия 8 класс; б) физика 7 класс ну очень средней школы.
. Дерзайте, коллега! Удачи!!!
-
. Да, про кухню и соли бария - грустноватый химический юмор...
P.S. Хотя, забавно было бы на СВЧ печку с огнеупорной "рубашкой" и термопарой взглянуть. К тому же и книжечку готовых рецептов можно было бы серьёзно увеличить засчёт сурово расширившихся возможностей...
-
Дядя составитель не понимает, что 50% раствор зело отличается от предельно разбавленного. И эффекты тут будут вовсе не школьного уровня.
. Так, судя по условию, дядя-составитель явно не об ионной силе думал...
-
Определите массу и состав осадка, выпавшего после смешивания 120 г раствора с w(ВаCl2)= 26% и 150 г раствора с w(NaNO3)=50%, если известно, что в данных условиях растворимость (в г на 1 дм3 воды)NaCl и Ba(NО3)2, равна соответственно 330,0 г и 90,45г.
. Плотности исходных растворов в студию, ибо без данных параметров задача не решабельна.
. С уважением
-
Прошу прощения, а количественное восстановление барита угольком в печке до растворимого сульфида, а затем уже содой карбонат бария осадить, как вариант, не подходит?! Или это слишком энергозатратным кажется?!
. С уважением
-
. А собственные мыслишки какие-нибудь имеются?!
-
 1
1
-
-
Я прочитал как мольная масса
 , извенияюсь. Раз эквивалентная, это меняет дело.
, извенияюсь. Раз эквивалентная, это меняет дело.. Я-то Вас понял, главное, чтобы молодёжь нас понимала !
-
Ну, ежели с ответом сходится, то почему ж не описать-то...
Рассуждения простые:
1) экв. масса алюминия = М(Al)•1/3 = 9 (г/моль экв), т.к. реакция-то ОВР (Al отдаёт 3 электрона);
2) найдёте n экв (Аl), а она равна и кол-ву эквивалентов соли (по закону эквивалентов);
3) далее это количество надобно умножить на экв. массу соли (из условия) - ответ готов.
. С уважением
а прикиньте, сколько весит 1 моль алюминия
0,45 алюминия и больше 2 г его соли?
. А, по-моему, ничего странного, ежели это хлорид алюминия, к примеру. Только в условии задачи очепятка, мне кажется. Эквивалентная масса соли 44,5 должна бы, по идее, быть.
. С уважением
-
 1
1
-
-
10^(-6) поделите на 0,013 и будет Вам счастье...
. С уважением
-
А у меня 2,275 г получилось, странно...
-
В газовой смеси ничего, кроме исходного этина и конечного бензола оказаться не может (см. уравнение реакции).
Находите молекулярную массу смеси исходя из плотности по воздуху.
Принимаете мольную долю бензола за икс и решаете линейное уравнение:
Х•Mэтина + (1-Х)•Mбензола = Мсмеси
Затем найдете массы бензола и смеси для 1 моль смеси, массовая доля бензола в смеси и будет практическим выходом бензола.
. По-моему, так...
-
Первое вещество (на картинке) названо неверно (нужно инвертировать нумерацию главной углеродной цепи), т.к. двойная связь является характеристической группой.
Второе и третье - верно.
А дальше?! Предположения закончились?
-
Напишите уравнения реакций, отвечающих представленным схемам, для каждой реакции укажите ее тип, для каждого вещества – его название и класс:
1.1. Al → Al2O3 → AlCl3→ Al(OH)3 → Na3[Al(OH)6] → Al2(SO4)3
1.2. NaCl ← Na → NaOH → NaHSO4 → Na2SO4 → BaSO4
1.3. C → CO2 → Na2CO3 → NaHCO3 → NaBr → AgBr
1.4. Cl2 → HCl → (FeOH)Cl → FeCl2 → Fe(OH)2 → Fe3(PO4)2
. Задания, прямо скажем, о-о-о-о-чень лёгкие, а аппетит у Вас, барышня, зверский. Печатать замучаешься, к тому же тип реакции - понятие совсем неконкретное, зависящее от критерия классификации. Вы бы хоть что-то попытались самостоятельно сделать, а то Ламарк (в вольном переводе) учил: "Что не тренируется, то отваливается (за ненадобностью)". За голову свою не боитесь?!
. С уважением
-
У бутина два изомера, и реакции с ними будут разные.
. Поэтому я ранее и попросил схему изобразить, а ТС что-то "уснул"...
-
. ПР это константа для данной температуры. Формулу Вы правильно написали, но в растворе нитрата стронция, сильного электролита, диссоциирующего полностью, равновесная концентрация катиона стронция будет равной 0,005 моль/л. Это значение и надо подставить в формулу ПР, откуда найдёте равновесную концентрацию фосфат-аниона (корень квадратный из отношения ПР к 0,005^3).
. Не забудем полученное значение поделить пополам и - вуаля! - получаем искомую растворимость фосфата в растворе нитрата.
. Вот так как-то...
-
. 1) составляете уравнение реакции, не забудьте уравнять;
. 2) находите количества вещества каждого из реагентов;
. 3) сравните соотношение полученных количеств вещества со стехиометрическим соотношением (коэффициенты из уравнения реакции), делаете вывод, какой из реагентов израсходовался полностью, по нему и посчитаете количество вещества, а затем и массу осадка (гидроксида никеля (II)).
. С уважением
-
Во сколько раз расторимость фосфата стронция в воде превышает его раствормость в 0.005 м растворе нитрата стронция?
. Для начала давайте определимся с растворимостью фосфата стронция в воде. Каковы Ваши мысли по этому поводу?
-
Восстановление оксида хрома (III) углеродом протекает по уравнению Cr2O3 + 3C = 2Cr + 3CO. Вычислите массу углерода, необходимую для восстановления 3 тонн оксида хрома (III).
. А по-моему, сударь, Вы несколько злоупотребляете. Задачи-то наиэлементарнейшие... Даже неловко как-то. Вам только что подобную задачу (с натрием) на блюдечке выложили, так по аналогии действуйте. Или аппетит приходит во время еды?! Это сладкое слово "халява"...
-
ок,а если переформулирую вопрос:как составить электронный баланс взаимодействия Бутина с перманганатом калия в кислой среде-четвергу -восстановитель,а как изменяется его степень окисления?
. Тогда для начала схему реакции (без коэффициентов) в студию!!! Потом с бутином будем разбираться...
. С уважением
-
При растворении натрия в воде выделилось 2,24 л водорода (при н.у.). Определите массу натрия, которое взяли для растворения.
. Для начала нужно уравнение реакции натрия с водой.
Затем найти количество вещества водорода (н.у. не зря указаны).
После по соотношению коэффициентов в уравнении реакции находим количество вещества натрия, а затем и его массу.
. Дерзайте, удачи!
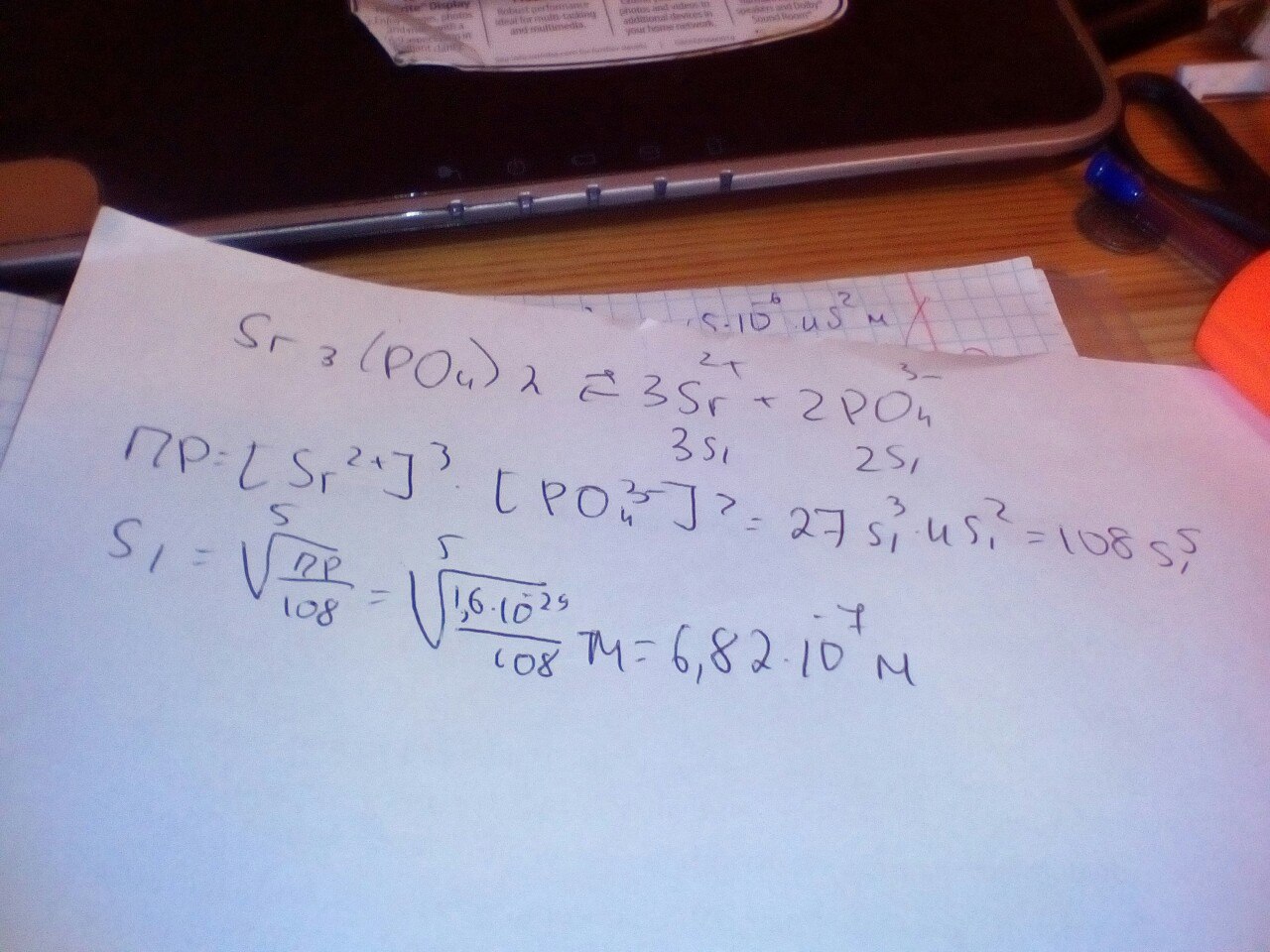
Аналитика
в Решение заданий
Опубликовано
На обиженных, как говорится, ... и далее по тексту. Хотя, вообще-то, не пристало Viking-ам так на "обиды" реагировать. Хочется надеяться, что гордость заела или совесть замучила. Но это всё лирика...
. А теперь серьёзно... Рискую быть обвинённым в мизантропии, но позволю, всё-таки, высказаться. К великому сожалению, вынужден констатировать наблюдаемый, особенно в последнее время, всё прогрессирующий облигатный интеллектуальный паразитизм, который зачастую, пусть неосознанно, поощряется(провоцируется) завсегдатаями-отвечающими.
. Не хотелось бы пускаться в псевдо- или околонаучные этимологические и лексические изыскания, просто выскажу своё мнение на проблему. "ПОМОЩЬ" - это содействие (поддержка), оказываемые субъекту при решении какой-либо конкретной задачи. Т.о. главным, в моём понимании, должен быть активный деятельностный компонент со стороны акцептора помощи. Понимание же многими "помощи" как "сделайте за меня, да, по возможности, поживее, а не то, какие ж вы эксперты, а я пока на диванчике поваляюсь" лично я не принимаю в принципе, считаю, что подобные медвежьи услуги не только не помогают (в истинном смысле), а, наоборот, развращают и калечат юные неокрепшие умы и души, развивая потребительские инстинкты.
. Прошу простить за возможно резкие высказывания, если так кому-то покажется, но, как говорится, замалчивать проблему, тоже, на мой взгляд, не выход...
. с уважением