-
Постов
1876 -
Зарегистрирован
-
Посещение
-
Победитель дней
6
Тип контента
Профили
Форумы
События
Сообщения, опубликованные pauk
-
-
В 12.05.2024 в 18:51, GeorgSwyat сказал:
У меня ни компьютер, ни телефон не читают этот формат, к сожалению.
Это очень распространённый формат для книжных файлов. Я несу свет знаний в тёмные массы благодаря именно этому формату. В интернете имеется куча софта для его чтения - от простеньких утилит до мегапакетов. Установите его на свой комп.
-
В 12.05.2024 в 18:44, GeorgSwyat сказал:
Файлы, кстати, не открываются
Скачал свои вложения на комп, все три открываются. У вас что-то с ПО, не читается формат djvu.
-
В 12.05.2024 в 18:18, GeorgSwyat сказал:
Спасибо, меня просто больше волнуют бензол и кофеин
Лиха беда начало! Дальше пойдут толуол и эфедрин. Так что намотайте на ус. Пригодится.
-
 1
1
-
-
В 12.05.2024 в 01:58, Paul_S сказал:
Для ЕГЭ, думаю, проканает также
KNO3 + Cu = KNO2 + CuO, KNO3 + K2SO3 = KNO2 + K2SO4 - при сплавлении
Эти не подходят, так как нет газовыделения.
-
В 12.05.2024 в 15:48, GeorgSwyat сказал:
Где можно найти целый список веществ, которые являются нелегальными/незаконными в РФ? Бензол и кофеин - легальные же соединения? Их можно получать в дом.условиях, в школе? Ибо видел и на Ютубе, и в интернете, что люди получают и дома. Я также обращался к УК РФ ст.234 и переходил по списку, но там не было ни бензола, ни кофеина. Зато хлороформ был, хлорэтил. Однако это вроде не та информация, которая мне нужна. Уже весь интернет облазил. И так и сяк.
Вот вам списки того, чего нельзя и того, что можно, но осторожно:
Перечень наркотических средств и их прекурсоров.djvu Изменения к списку наркотических веществ и прекурсоров.djvu Перечень СДЯВ.djvu
В списки время от времени вносятся изменения. Я за этим не слежу, поэтому некоторые данные из списков могут отличаться от ныне действующих правил. Но думаю, что эти списки вас устроят.
-
Аркадий промахнулся. Дипольный момент воды не высота равнобедренного треугольника, а его основание.
Правило сложения векторов. Рисовать мне нечем, попробую объяснить на пальцах. Вначале имеем два исходящих из одной точки вектора длиной 1,58 и искомым углом α между ними. По биссектрисе этого угла направлен результирующий вектор 1,84. Не меняя направления, сдвигаем первый вектор из начальной точки в конец второго вектора. Получаем равнобедренный треугольник со сторонами 1,58 и основанием 1,84. Опускаем перпендикуляр из вершины треугольника на основание. Треугольник равнобедренный, поэтому высота делит основание на две равные части по 0,92. Получился прямоугольный треугольник с гипотенузой 1,58, катетом 0,92 и углом между ними φ = α/2. По определению сos φ = 0,92/1,58 = 0,5823. По таблицам или калькулятором вычисляем угол φ, а затем угол α = 2φ.
-
В 10.05.2024 в 23:33, halabuda сказал:
В ходе реакции был получен дигидроксокарбонат меди(II), какими химическими свойствами он обладает? Википедия, конечно, об этом пишет, но список получается очень скудный. Понятно, что он разлагается при нагревании и вступает в реакции с кислотами, но как, например, будет проходить реакция с другими солями, будет ли идти реакция с сульфатом магния или хлоридом натрия?
С этими солями не будет, а вот с сульфидом или гидросульфидом натрия обязан будет реагировать. Дигидроксокарбонат меди(II), что в переводе на человеческий язык означает малахит, хоть и нерастворим в воде, но сульфид меди ещё нерастворимее. В итоге зелёный осадок хоть и не растворится, но почернеет от горя по реакции:
Cu2(OH)2CO3 (зелёный) + 2Na2S -> 2CuS (чёрный) + Na2CO3 + 2NaOH
Или:
Cu2(OH)2CO3 (зелёный) + 2NaHS -> 2CuS (чёрный) + Na2CO3 + 2H2OАналогичная картина будет при действии раствора щёлочи (для ускорения реакции раствор желательно подогреть):
Cu2(OH)2CO3 (зелёный) + 2NaOH -> 2Cu(OH)2 (голубой) + Na2CO3 -> 2CuO (чёрный) + Na2CO3 + 2H2OА если, к примеру, взять раствор сульфата железа(III), то осадок забуреет, а малахит с перепугу превратится в купорос:
3Cu2(OH)2CO3 (зелёный) + 2Fe2(SO4)3 + 3H2O -> 4Fe(OH)3 (бурый) + 6CuSO4 + 3CO2↑
И т. д.
Отчего случаются столь странные вещи, вы можете узнать, проштудировав раздел учебника по аналитической химии, касающийся обменных реакций между ионами в растворе и в осадке.
-
 2
2
-
-
Если приспичило получить цианид калия, то сплавлять надо с железом.
-
В 11.05.2024 в 00:11, Kierowca сказал:
Вспомнил давние времена, Яштолд-Говорко В. А. "Фотосьемка и фотообработка" издательства 1966-го года мой букварь фотографии со школы. Сравнил, разделы по химии похожи, но версия 1956-го года шире. Почитаю, есть о чем думать.
Да и кто сказал, что для фиксирования обязательно должен использоваться гипосульфит?
Еще из обзорной литературы предложу К.В. Чибисова "Общая фотография", Москва, "Искусство" 1984г. Книга менее прикладная, но кто интересуется, должна понравится. Ссылок на нее, увы, не имею.
Этой книги Чибисова на Либгене я не нашёл, но там есть парочка других:
Чибисов К. В. - Очерки по истории фотографии (1987)
Чибисов К. В. и соавт. - Фотография в прошлом, настоящем и будущем (1988)
Если интересуют, то вот ссылки на страницы, откуда их можно скачать:PS. Я тоже вспомнил молодость и полез в шкап с многолетними залежами книг. Нарыл там около десятка книг по фотографии. Список книг в спойлере, но сейчас эта тематика уже неактуальна, я думаю. На досуге полистаю, но не уверен, что в них есть что-либо кардинальное по вашей проблеме. В каждой книге ещё по полтора-два десятка библиографических ссылок, но я искать по ним не буду, не моя тема. Если откопаю что-нибудь заслуживающее внимания, то тисну сюда сообщение.
СпойлерРедько - Основы чёрно-белых и цветных фотопроцессов. М., 1990, 256 с.
Вартанов/Луговьер - Учись фотографировать. М., 1988, 224 с.
Анцев/Доброславский - Фотолюбитель-конструктор. М., 1989, 192 с.
Греков - Справочник фотографа. Новосибирск, 1991, 186 с.
Киселёв/Виленский - Физические и химические основы цветной фотографии. Справочное пособие. Л., 1988, 304 с.
Журба - Краткий справочник по фотографическим процессам и материалам. М., 1991, 352 с.
Шеклеин - Фотографический калейдоскоп. М., 1990, 192 с.
Волгин - Техника цветной фотографии. М., 1987, 144 с.
Картужанский/Красный-Адмони - Химия и физика фотографических процессов. Л., 1987, 136 с.-
 3
3
-
-
В 11.05.2024 в 01:40, Shizuma Eiku сказал:
Они не разделяются, там перенос строк просто
Вы меня не поняли, я вовсе не разветвление цепочки (которого там нет) имел ввиду, а то, что в задании надписи над стрелками разделяют реакции на два самостоятельных вида, хотя в общем случае они относятся к одному типу (межмолекулярная дегидратация).
-
В 11.05.2024 в 01:04, Shizuma Eiku сказал:
А я вообще задания не видел

Реакция этерификации с образованием сложного эфира может рассматриваться как частный случай межмолекулярной дегидратации. Но дело в том, что в данном задании эти реакции разделяются, там дальше над стрелкой есть название "этерификация".
В 11.05.2024 в 01:23, Paul_S сказал:Ну, неправда это. Такой клюквы даже в википедии нет. Обугливается уксусная кислота с P2O5, я это пытался делать когда-то. И с серной к-той тоже, думаю, ничего не будет. Если бы ацетангидрид так запросто получался, не было бы смысла его запрещать

Да я не оспариваю фактуры, ибо сам об этом знаю. Просто предложил кривой школьный метод, с которым сам сталкивался неоднократно.
-
В 11.05.2024 в 00:42, Shizuma Eiku сказал:
Если цепочка уксусная кислота -> X -> ацетат натрия, то там совсем не обязательно Х ангидрид, там например может быть сложный эфир уксусной кислоты.
Какой к чёрту сложный эфир? Там же чёрным по-русски написано над стрелкой: межмолекулярная дегидратация.
-
В 10.05.2024 в 23:22, Paul_S сказал:
В какой школе такую реакцию проходят, интересно? Там все обугливается. С трифторуксусной к-той это работает. Но не с уксусом.
Да до фига таких школьных пособий! Вот чуть ли не первое попавшееся:
В 11.05.2024 в 00:40, GeorgSwyat сказал:Ну а относительно цепочки мне что делать? Там же А - кислота, а Б - ангидрид, по идее.
Если от абстрактной теории перейти к суровой практике, то тогда предлагаю вставить в цепочку реакцию уксусной кислоты с фосгеном. Реакция не школьная, но зато практическая, стопудово. Раньше так его и производили. Реакция соответствует определению "межмолекулярная дегидратация", тоже стопудово.
2CH3COOH + COCl2 (~70°C; kat. AlCl3) -> (CH3COO)2 + CO2 + 2HCl -
В 10.05.2024 в 22:23, GeorgSwyat сказал:
Мне просто по условию нужна именно межмолекулярная деградация
А это именно она и есть. Только не деградация, а дегидратация.
-
В 10.05.2024 в 21:18, Paul_S сказал:
Я не слышал, чтобы это делалось в одну стадию. Делают через кетен.
А почему нельзя пришпилить сюда школьную реакцию типа 2CH3COOH + P2O5 -> (CH3COO)2 + 2HPO3?
На худой конец можно сослаться на формально одностадийный промышленный процесс получения уксусного ангидрида дегидратацией уксусной кислоты, как глаголет ХЭ.ЦитатаВ пром-сти уксусный ангидрид получают разложением CH3COOH в присут. триэтилфосфата (0,3% по массе) при 680-720°C и давлении 26,2-52,4 кПа (степень конверсии 80-84%, селективность 87-91%):


-
В 10.05.2024 в 01:44, Romix сказал:
Куда деётся Фосфор с растений при их сжигании, Азот я понимаю улетучивается.
Фосфор тоже улетучивается что-ли? Почему этого не происходит с костями, а он в них остаётся анионом...Возможно. Вот тут пишут, что в растении органического фосфора намного больше, чем неорганического:
ЦитатаФосфор в растениях представлен в минеральном (5-15%) и органическом (85-95%) виде. Минеральные соединения фосфора — фосфаты калия, кальция, магния и аммония. Органические соединения: нуклеиновые кислоты, нуклеопротеиды и фосфатопротеиды, аденозинфосфаты, сахарофосфаты, фосфатиды, фитин.
Когда органика сгорает, куда деваться фосфору? Если катионов, чтобы связаться с ними в фосфаты, не хватит, то придётся ему лететь к небу сизым облаком вместе с остальной братией.
-
dmr, да вы прям как моя прабабушка ворчите:
ЦитатаВ бога не веритё, в церковь не ходитё. А если и ходитё, то только стоитё да пердитё. Воздух портитё.
Ничего страшного в этом нет, дело молодое, научится. Как говорили древние:
ЦитатаДорогу осилит идущий.
-
 1
1
-
-
В 09.05.2024 в 22:53, Nemo_78 сказал:
Хочу поздравить всех не только с 79-ой годовщиной Великой Победы, но и со столетним юбилеем Б.Ш. Окуджавы.
А также с 80-й годовщиной освобождения Севастополя.
-
В 09.05.2024 в 20:07, ellamalyshka13 сказал:
составтье элекроннный баланс ,без дробного значения 🙏
В магнетите Fe3O4 степени окисления атомов Fe разные: один атом Fe+2 и два атома Fe+3. Это становится очевидным, если его формулу условно представить в виде двойного оксида FeO*Fe2O3. Таким образом, в данной ОВР восстанавливаются не все атомы железа, а только два. Третий атом железа степень окисления не меняет, т. к. она у него уже изначально была +2.
Пишем схему электронного баланса, она несложная:
*1| 2I-1 - 2e -> I20
*2| Fe+3 + e -> Fe+2Далее переходим к составлению уравнения в молекулярной форме с учётом коэффициентов ОВР.
1-й этап. 2HI + Fe3O4 -> I2 + FeI2 + H2O. Здесь 2HI и I2 мы записали согласно схемы электронного баланса, а формулу Fe3O4 записали целиком, так как в ней как раз присутствуют два атома Fe+3, что и требуется по схеме.
2-й этап. 2HI + Fe3O4 -> I2 + 3FeI2 + 4H2O. Ставим коэффициенты 3 и 4 перед FeI2 и H2O, уравнивая тем самым количества атомов Fe и O в обеих частях уравнения.
3-й этап. 8HI + Fe3O4 -> I2 + 3FeI2 + 4H2O. Уравниваем количество атомов I (можно было начать и с уравнивания атомов H, это абсолютно ничего не меняет). Справа восемь атомов I, а слева только два. Ставим коэффициент 8 перед HI. При этом одновременно автоматически уравнялось количество атомов H.
4-й этап. Проверяем, правильно ли выполнено уравнивание и записываем окончательное уравнение:
8HI + Fe3O4 = I2 + 3FeI2 + 4H2O.
5-й этап. Идём с этим уравнением к преподу и получаем пять баллов.-
 1
1
-
-
В 07.05.2024 в 13:17, Kierowca сказал:
Имею старое семейное фото, XIX-й век, изображение блеклое, неровное, местами нулевое, тон возможно родной - "сепия" (Ag2S, либо вирировалась серной печенью). Как восстановить изображение?
Когда то давно встречал книгу/и с рецептами, теперь все перерыв прошу совета.
Вот книга: Мархилевич К. И., Яштолд-Говорко В. А. - Фотографическая химия (Библиотека фотолюбителя, вып. 10), 1956. В ней по косточкам разбирается физико-химическая сущность всех основных процессов в фотографии, начиная от экспонирования фотоматериалов и кончая устранением дефектов (пятен) на отпечатках. Если эта книга вам не поможет, то помочь уже не сможет ничто.
Есть ещё похожее более позднее издание: Терегулов Г. И. - Химия для фотографа (Массовая фотографическая библиотека), 1976. Но в ней нет главы об устранении дефектов.
Редактор обеих книг один и тот же - Е. А. Иофис. Только в первой книжке он был к.т.н., а во второй уже д.т.н.
Эти книжки есть на Либгене. Вот ссылки на страницы, с которых их можно скачать:
-
 3
3
-
-
Из книги Миниович М. А., Миниович В. М. - Соли азотистой кислоты (Нитриты), 1979:
Mg(NO2)2 - бесцветные кристаллы нечётко выраженной моноклинной формы. На воздухе кристаллы расплываются.
Температурные интервалы существования кристаллогидратов, °С:
Mg(NO2)2*3H2O от + 29,5 и выше
Mg(NO2)2*6H2O от + 10,5 до + 29,5
Mg(NO2)2*9H2O от - 21 до + 10,5Способен разлагаться с образованием нитрата магния и окиси магния. Хорошо растворяется в воде. Водные растворы при повышенной температуре подвержены гидролизу с образованием основной соли. Под действием света и кислорода воздуха водные растворы могут частично окисляться до нитрата. При 20°С насыщенный раствор концентрацией 42,85% имеет плотность 1319,1 кг/м3.
В промышленности нитрит магния получают только конверсионными методами. Попытки получать его прямым методом из гидроокиси магния и окислов азота дали неудовлетворительные результаты. В образующихся после абсорбции растворах содержание примеси нитрата магния достигало 20%.
Нитрит магния можно получать следующими методами:
- обменным разложением между растворами MgCl2 и AgNO2 (при этом получается нитрит магния с очень небольшим количеством примесей)
- обменным разложением между растворами MgCl2 и NaNO2 (в конечных растворах содержится 1-2% исходных компонентов)
- обменным разложением между растворами Ba(NO2)2 и MgSO4Последний метод сводится к следующему. При 30°С раздельно готовят насыщенные растворы Ba(NO2)2 и MgSO4. Затем к нагретому до 40°С раствору Ba(NO2)2 постепенно отдельными порциями добавляют раствор MgSO4 и тщательно перемешивают с помощью мешалки. При этом проверяется и корректируется полнота осаждения ионов SO42- и Ba2+. После отстаивания раствор Mg(NO2)2 концентрацией 11-12% сливают с осадка и упаривают при температуре не выше 55-60°С.
Для получения шестиводного гидрата раствор выпаривают до концентрации 45-46%, после чего охлаждают до температуры минус 10-15°С. Кристаллизация раствора протекает быстрее, если в него добавить в качестве затравки небольшое количество кристаллов Ba(NO2)2*2H2O. Кристаллизацию следует проводить без доступа воздуха не только для предотвращения окисления, но и для получения нитрита без примеси углекислого магния. Выход по этому методу составляет не менее 70%.
По ряду причин в производственных условиях не кристаллизуют упаренные растворы нитрита магния. Его выпускают в виде раствора, содержащего не менее 25% основного вещества. Применяют растворы нитрита магния в препаративной химии.
Насчёт нитрата магния в аналогичной книжке Миниович М. А. - Соли азотной кислоты (Нитраты), 1946 информации вообще мало. Рассматриваются лишь некоторые свойства кристаллогидратов, приведена таблица плотности насыщенных растворов при различной температуре, краткое описание промышленного метода производства из природного магнезита (MgCO3) и азотной кислоты, а также методика анализа готового продукта.
-
 1
1
-
-
В 08.05.2024 в 00:53, аналитичка сказал:
Доброго времени суток. Знающие люди, подскажите, что и как.
Диоксид церия принес много проблем, так как ни в чем почти эта дрянь не растворяется. В смеси серной концентрированной и перекиси он растворяется хорошо, но смесь HNO3 и H2O2 не работает. Почему так? Если опираться на то, что протекает ОВР, то пероксид восстановитель , церий окислитель и будто бы азотная кислота тоже должна подходить. Раствор по итогу получился прозрачный, т.е. церий из 4-х валентного перешел в трех, потому что ионы Се4+ имеют оранжевый цвет, насколько я знаю. В чем роль именно серной кислоты, может там комплекс образуется какой-то.
В интернете есть следующие книги:
1. Иост Д., Рессель Г., Гарнер К. - Редкоземельные элементы и их соединения (1949)
2. Серебренников В. В. - Химия редкоземельных элементов. Том I. Книга 1 (1959)
3. Серебренников В. В. - Химия редкоземельных элементов. Том II. Книга 2, 3, 4 (1961)
4. Шахно И. В. и др. (под ред. А. К. Большакова) - Химия и технология редких и рассеянных элементов. Часть II (1976)В [1] информации по соединениям Ce(IV) немного (стр. 92-95). В частности, авторы пишут, что кристаллическая CeO2 не растворяется в азотной кислоте, но в присутствии перекиси водорода растворяется с образованием соли церия(III). Образование комплексов с нитратами малохарактерно.
Так что уравнение реакции можно записать в виде: 2CeO2 + H2O2 + 6HNO3 = 2Ce(NO3)3 + O2↑ + 4H2O
Что у вас не так - хз (хотелось знать).
Источники [2-4] более капитальные, из них можно почерпнуть гораздо больше полезной информации.
-
В 07.05.2024 в 21:56, dmr сказал:
Что реально можно перекисью окислить квасцы до хроматов?
Реально. Для ускорения реакции требуется нагревание. В прошлом или позапрошлом году на форуме было выложено видео реакции сульфата хрома(III) с перекисью водорода в щелочной среде, то бишь фактически с ионами [Cr(OH)6]3-. К сожалению, найти его не удалось. С этими новыми правилами поиска легче найти иголку в стоге сена. Я свои собственные позавчерашние посты найти не могу, что уж там говорить про прошлогодний контент.
-
 1
1
-
-
В 07.05.2024 в 09:51, barrrley сказал:
Какой объем 3% раствора H2O2 (p = 1) потребуется для окисления KCr(SO4)2 в 0,5 л раствора, если концентрация соли 0,1 моль/л?
2KCr(SO4)2 + 3H2O2 + 10KOH = 2K2CrO4 + 4K2SO4 + 8H2O
2 моль KCr(SO4)2 -- 3 моль H2O2
0,5*0,1 моль KCr(SO4)2 -- х моль H2O2
х = 0,5*0,1*3/2 = 0,075 моль H2O2 = 0,075*34 = 2,55 г H2O2100 г 3% р-ра H2O2 -- 3 г H2O2
y г 3% р-ра H2O2 -- 2,55 г H2O2
y = 2,55*100/3 = 85 г 3% р-ра H2O2 = 85/1 = 85 мл 3% р-ра H2O2





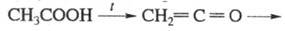
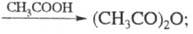
Макдональдс почему вкусно?
в Общий
Опубликовано
Часто вегетарианцы оправдываются тем, что всё дело не в составе пищи, а в моральных принципах. Жестоко и негуманно лишать жизни божьих тварей. А чем поедание трупов убиенных растений гуманнее поедания трупов убиенных животных?