Поиск
Показаны результаты для тегов 'РАВНОВЕСИЕ'.
Найдено 24 результата
-
Как сместить равновесие реакции PCl5 PCl3 + Cl2 – Q Дж: а) в прямом направлении; б) в обратном направлении?
- 2 ответа
-
- неорганическая химия
- равновесие
-
(и ещё 2 )
C тегом:
-
Как найти исходную концентрацию вещества А в реакции A+B=C+D?
Karina_b опубликовал тема в Решение заданий
Химическое равновесие реакции A+B=C+D (газы) установилось при следующих концентрациях : [A]=6 моль/л, [В]=2моль/л, [С]=4 моль/л, [D]=3 моль/л. Рассчитайте константу равновесия и исходную концентрацию вещества А. Константу то рассчитали, а вот как найти исходную концентрацию? -
Есть три уравнения: Pb(NO3)2 + 2KI = PbI2 +2KNO3 PbI2+ KI = K[PbI3] K[PbI3] + 2H2O = K[PbI3]*2H2O Вычислить константу совмещенного равновесия
-
CH3COO- + NH4+ + HOH ↔ CH3COOH + NH4OH Концентрация исходной соли (CH3COONH4) = 0.1M, необходимо найти pH раствора. В результате расчетов через константы: равновесия, воды, ионизации уксусной кислоты и раствора аммиака; были получены концентрации уксусной кислоты и раствора аммиака равные 3.16*10-5 CH3COOH ↔ CH3COO- + H+ Через константы равновесия и ионизации уксусной кислоты была получена концентрация ионов гидроксония, равная 9.2*10-5 NH3*H2O ↔ NH4+ + OH- Далее, через константы равновесия и ионизации раствора аммиака была получена концентрация гидроксоионов, равная 9.1*10-5 В таком случае произведение вычисленных концентраций ионов H+ и OH- должно быть равно 10-14, кроме того если вычислить pH по концентрации H+, то получится около 4, чего не может быть. В чем ошибка?
- 4 ответа
-
- гидролиз
- равновесие
-
(и ещё 1 )
C тегом:
-
Напишите уравнения электронейтральности для: концентрированной соляной кислоты; Рассчитайте активность иона водорода в 0,010 М растворе соляной кислоты в присутствии 0,05 М сульфата натрия.Дорогие форумчане, я сомневаюсь в правильности решения задач. Помогите мне пожалуйста
-
- константы
- равновесие
-
(и ещё 1 )
C тегом:
-
Здравствуйте, помогите пожалуйста решить. 1. Константа равновесия реакции = 0,1 при Т=673 К. N2 + 3H2 = 2NH3 Равновесные концентрации (моль/л): [H2] = 0,6 и [NH3] = 0,18. Вычислите: 1) начальную и равновесную концентрации азота; 2) степень превращения N2 и равновесный выход продукта. 2. При какой температуре равновесный выход CO2 (г) по реакции: CH4(г) + 2 H2O(г) = CO2(г) + 4H2(г) будет равен 50%, если в исходной реакционной смеси содержится 30% (CH4) и 60% (H2O) и Рсмеси = 1 атм?
-

равновесие Какой гидроксид использовать для реакции с Fe^3+?
dsgalyamov опубликовал тема в Решение заданий
Объяснить, какой гидроксид а)KOH; б) NH4OH; в) Cr(OH)3необходимо взять для осуществления реакции в соответствии со следующим сокращенным ионно-молекулярным уравнением: Fe^3+ + 3OH^- =Fe(OH)3. Я даже не понимаю с чего тут начать,помогите пожалуйста -
При некоторой температуре газовая смесь содержит следующие количества веществ: 2,0 моль H2O, 0,20 моль H2 и 0,10 моль O2, находящихся в равновесии 2H2+O2=2H2O При охлаждении до 800 градусов Цельсия константа равновесия изменилась в десять раз. 1. Рассчитайте кол-ва веществ (можно приблизительно) в образовавшейся при охлаждении равновесной смеси. 2. Платина является катализатором данной реакции. Как повлияет на равновесие внесение платины в процессе охлаждения смеси. 3. Почему температура влияет на положение хим. равновесия? 4. Может ли выход в какой-либо реакции не зависеть от температуры?
-
Как изменится степень диссоциации PCl5 при добавлении N2?
MikhailDemin опубликовал тема в Решение заданий
При 250oC и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции PCl5 (г) = PCl3 (г) + Cl2(г). Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм. -
Помогите сделать лабораторную работу График и таблицу записал. вот как дальше эти 2-4 пункты из цели делать не знаю.
-
- химия
- равновесие
-
(и ещё 1 )
C тегом:
-
Добрый вечер! 1. 30% по массе раствор NaOH в воде, плотностью 1,32 г/см3 . Определить его мольную долю; молярность; нормальность, моляльность. Какой объем этого раствора нужно взять для приготовления 100 мл 0,01 Н нормального раствора. 2. Напишите уравнение гидролиза Cr2(SO4)3 . Укажите рН водного раствора этой соли. Как сместится равновесие, если повысить температуру; добавить воду; растворы HCl, NaOH, ZnSO4, K2CO3. (В принципе, тут мне непонятно только с рН и с равновесием. Скажите еще пожалуйста принцип добавляемых в раствор веществ) 3. Написать уравнения электро-химической коррозии происходящей при контакте металлов Mg-Cr в атмосфере и кислой среде. Укажите продукты коррозии в каждом случае. (Вот тут прошу поподробнее т.к. преподаватель тему объяснить не успел, но на экзамен вынес.) Заранее спасибо за помощь от всей группы.
- 1 ответ
-
- мольная доля
- моляльность
- (и ещё 4 )
-
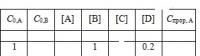
Здравствуйте всем Помогите кто чем может. Тема актуальна до 26.12.13. Даны две задачи на химическое равновесие: 1) Дано уравнение реакций и концентрация веществ. Обозначения: С0 – исходная концентрация, [ ] – равновесная концентрация, Спрор – концентрация прореагировавшего вещества. Исходные концентрации веществ С и D равны нулю. Все концентрации заданы в моль/л. Определите неизвестные концентрации. Само уравнение выглядит так: 3А +2В ---> 2С+D Известные данные на вложенной фотографии (Безымянный1111111.jpg) Я попробывал ее решить, мои результаты похожи на ахинею... : 1 0.6 0.6 1 0.4 0.2 1.6 Проверьте пожалуйста, если есть возможность) 2) Константа равновесия реакции C2H5OH + CH3COOH = CH3COOC2H5 + H2O равна 3,8. Сколько моль эфира образуется, если смешать 1 моль/л спирта и 2 моль/л кислоты (начальные концентрации эфира и воды равны 0)? 3.bI. В этой задачи у меня не получилось написать больше чем условие. Подскажите пожалуйста с чего начать)
-
Вычисление равновесных концентраций, константы равновесия
Сигизмунд опубликовал тема в Решение заданий
Здравствуйте! Помогите решить задачу. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30% вещества А и вычислите константу равновесия. aA+bB=cC+dD 2CH3OH(г)+3O2(г)= CO2(г)+2H20(г) C0(A)=3 C0(B )=3 (В-во (A) - CH3OH, (B ) - O2 ). Буду очень благодарен за понятное решение. Заранее спасибо.-
- концентрация
- химия
-
(и ещё 2 )
C тегом:
-
Написать уравнение константы равновесия для обратимой реакции. Укажите в какую сторону сместится равновесие: а) повышение давления, понижение давления. б) повышение температуры, понижение температуры
- 9 ответов
-
- выражение
- равновесие
-
(и ещё 2 )
C тегом:
-
Как сместится химическое равновесие в разных условиях?
dima123dima опубликовал тема в Решение заданий
Помогите решить задачи пожалуйста 1)В каком направлении сместится равновесие реакции при уменьшении концентрации второго из исходных веществ: 3H2(Г) + N2(Г) Û 2NH3(Г) 2)В каком направлении сместится равновесие реакции при понижении температуры: 2HBr(Г) Û H2(Г) + Br2(Г) Δ Н0 = 72,6 кДж 3)В каком направлении сместится равновесие реакции при понижении давления 2H2O(Г) + 2Cl2(Г) Û 2HCl(Г) 4)) Напишите выражение константы равновесия реакции: 2SO2(Г) + O2(Г) Û 2SO3(Г) -
Как закон действия масс связан с уравнениями скорости реакций?
iNsiG опубликовал тема в Решение заданий
Какую зависимость выражает закон действия масс ? Напишите уравнение скорости для реакций: H2(г)+CI(г)=2HCl(г) C(т)+CO2(г)=2CO(г) -
Помогите ребят с задачей если кто может. Какое влияние на равновесную концентрацию хлора в системе 4HCl+O2-->2Cl2+2H2O-113кДж окажут 1)увеличение давления2)увеличение концентрации хлора 3)введение катализатора????????????
-
1. Исходя из данных: ∆H0,298 ( As 2 O 3 ) = −1335 , f ∆H0,298 ( As 2 O 5 ) = −925 f и ∆H0,298 (O 3 ) = 142 (кДж/моль), - рассчитать изменение энтальпии реакций: f а) As 2 O 3 + O 2 → As 2 O 5 , б) As 2 O 3 + O 3 → As 2 O 5 , - и сделать вывод. 2. Пользуясь значениями ∆H0 образования отдельных соединений и их S 0 , 298 298 вычислить ∆G 0 процессов: а) COCl2 = CO + Cl2 , б) SO 2 + NO 2 = SO 3(г ) + NO , и определить, возможно ли осуществление их в стандартных условиях. 3. При повышении температуры на 500С скорость реакции возросла в 1200 раз. Рассчитать температурный коэффициент Вант-Гоффа. 4. Найти температурный коэффициент Вант-Гоффа, если константа скорости реакции при 1200С составляет 5,9 ⋅ 10 −4 , а при 1700С равна 6,7 ⋅ 10 −2 (моль/(л·с). 5. Вычислить процент разложения молекулярного хлора на атомы, если кон- станта равновесия составляет 4 ,2 ⋅ 10 −4 , а исходная концентрация хлора 0,04 моль/л. 6. Реакция идет согласно уравнению: 2NO (г ) + Cl2(г ) = 2NOCl (г ) . Исходные концентрации веществ составляют: C(NO) = 0,8 моль/л, C(Cl2 ) = 0,6 моль/л. Во сколько раз изменится скорость процесса по сравнению с первоначальной в тот момент, когда успеет прореагировать половина количества NO? 7. Две реакции имеют одинаковый порядок и предэкспоненциальный множи- тель, но их E a различаются на 100 кДж/моль. Во сколько раз константа скорости од- ной реакции будет больше константы скорости второй при 500 К? при 1000 К? 8. Константа равновесия реакции: CO (г ) + Cl2(г ) = COCl2(г ) , при некоторой тем- пературе равна 6. Найти равновесные концентрации всех веществ, если их исходные концентрации: C(CO) = 1 моль/л, C(Cl2 ) = 1 моль/л, C(COCl2 ) = 1 моль/л. 9. Константа равновесия реакции: CO (г ) + Cl2(г ) = COCl2(г ) , при некоторой тем- пературе равна 6. В каком направлении будет протекать реакция при следующих исходных концентрациях веществ: 2 моль СО, 2 моль Сl2, 8 моль СОСl2? Рассчитать равновесные концентрации. 10. Вычислить константу равновесия системы: CO (г ) + Cl2(г ) = COCl2(г ) , если C(CO) исх . = C(Cl2 ) исх . = 4 моль/л, C(COCl2 ) исх . = 0 , а [COCl2 ] = 3,27 моль/л. 11. Определить выход NO в процентах (по объему), если исходные газы взяты из воздуха в объемном отношении 4:1, а K a = 5 ⋅ 10 −3 . 12. Найти равновесную концентрацию водорода в системе: H2 S → H2 + S , если исходная C(H2 S) составляет 0,05 моль/л, а K a = 902 . 13. Сколько молей HZ образуется в системе H2 + Z 2 = 2HZ из одного моля Z2 и двух молей H2, если K а = 50 ? 14. При сгорании 1 л ацетилена, взятого при нормальных условиях, выделяет- ся 58,2 кДж. Вычислить теплоту образования С2Н2, если теплоты образования СО2 и H2 O ( ж ) равны, соответственно, -393 и -286 кДж/моль.
-
Рассчитать Кс реакции 2H2(г)+S2(г)=2 H2S(г), если исходные концентрации H2 и S2 составляют соответственно 4 и 3 моль/л и к моменту равновесия прореагировало 70% исходного количества H2. Записать математическое выражениеКр и определить совпадают ли Кр и Кс численно.
-
1. Найти температуру, при которой константа равновесия реакции 4НС(г)+O2(г)↔2H2O(г)+2Cl(г) равна единице. Записать выражение для константы равновесия данной реакции. 2. Разложение N20 на поверхности золота при высоких температурах протекает по уравнению 2N20(г)↔2N2(г) +O2(г). Константа скорости данной реакции равна 5*10-4 Начальная концентрация N20 - 3.3 моль/л. Определить скорость реакции при заданной температуре в начальный момент времени и в тот момент, когда разложится 25% N20.
-
Как найти константу равновесия по известным концентрациям?
anton1440 опубликовал тема в Решение заданий
Как найти константу равновесия если Са = 0,7 моль/л, Св = 1,25 моль/л, Сс = 0,33 моль/л Аа + Вв + Сс → pP -
Принцип Ле-Шателье знаю Какие факторы способствуют смещению равновесия в системе С(т) + 2H2(г) CH4(г) + 74.9 кДж в сторону образования метана (CH4) ? Ответ мотивировать.