-
Постов
33402 -
Зарегистрирован
-
Победитель дней
1107
Тип контента
Профили
Форумы
События
Весь контент yatcheh
-
Шоб не пролить - плошку поширше. Пока ты тут щёлкаете клавиатурой - уже давно бы всё упарилось.
-
Собственно, и "какая-нить" кислота не нужна, и глицерин не нужен. Переводим КМЦ в кислотную форму и этерифицируем имеющиеся -COOH группы имеющимися гидроксилами. Получаем сшитый полимер
-
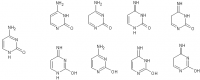
Ни хера не понял. С чего вдруг продукт кротоновой конденсации ещё и с аммиаком реагирует? Реакция кетонов с аммиаком очень неоднозначная, там масса всяких продуктов может получаться. Тем более, если это альфа-непредельный кетон, там вообще полный ахтунг будет в продуктах.
- 4 ответа
-
- органика
- особенности кетонов
- (и ещё 1 )
-
dT = E*a, где dT - повышение тем-ры кипения Е - эбуллиоскоп-я константа а - моляльность раствора (моль/1000 г р-ля) отсюда: E = dT/a dT = 58.73 - 58.3 = 0.43 a = 2.3/М(глиц.)/100*1000 = 0.25 E = 0.43/0.25 = 1.72
- 1 ответ
-
- 1
-

-
Если 0.03*1000/2 >= 18 то может, иначе - не может
- 3 ответа
-
- 1
-

-
Налить в плошку и поставить на батарею.
-
Йодистый метил с бикарбонатом - это совсем другая песня. Бикарбонат в этом случае не катализатор, а реагент. Реакция идёт фактически между солью кислоты (образующейся при реакции с бикарбонатом) и йодистым метилом. У вас же этерифицирующий агент - спирт. Каталитическое действие основания наблюдается только при этерификации высших жирных кислот, с низшими этого эффекта нет, поэтому речь может идти о мицеллярном катализе. Для этерификации спиртом нужна именно кислота, соль этерифицироваться не будет. То есть КМЦ в COONa-форме нужно количественно перевести в COOH-форму, а для этого простой "добавки" лимонной кислоты недостаточно. Если рассматривать КМЦ как ионообменную полимерную матрицу, то надо заключить её в колонку и промывать раствором кислоты, пока весь натрий не вымоется. Но это - теория, как практически это сделать - хрен его знат. Можно просто добавить эквивалент раствора сильной кислоты (типа серной или соляной). Натрий останется болтаться в виде сульфата/хлорида. Насколько он потом будет мешать - опять же неизвестно. Уксусная кислота не поможет. Слабая она, да и этерифицироваться будет не хуже (как, впрочем - и лимонная). Гидрофобным такой полимер точно не будет. Так же будет в воде набухать. Разве что потеряет свойства клея.
-
У вас справа - продукт восстановления нитросоединения. А подразумевается гидролиз: R-NO2 --(H+, H2O)--> R-OH + HNO2 Бред, конечно, но бумага стерпит
- 2 ответа
-
- 1
-

-
CH3-CH2-CO-CH(CH3)2 + NH3 CH3-CH2-C(NH2)(OH)-CH(CH3)2 CH3-CH2-C(=NH)(OH)-CH(CH3)2 продукты олигомеризации CH3-CH2-CO-CH(CH3)2 + CH3OH CH3-CH2-C(ОН)(OCH3)-CH(CH3)2 CH3-CH2-C(OCH3)2-CH(CH3)2 CH3-CH2-CO-CH(CH3)2 --(EtONa)--> CH3-CH2-CO-CH(CH3)2 + NaHSO3 CH3-CH2-C(-OH)(-SO3Na)-CH(CH3)2 Эта реакция действительно не идёт. Точнее, равновесие практически полностью сдвинуто влево, и продукта в смеси - меньше 1%
- 4 ответа
-
- органика
- особенности кетонов
- (и ещё 1 )
-
Неправильный переход от стереопроекции к проекции Фишера.
- 1 ответ
-
- 1
-

-
Опасность представляет накопление гидроперекисей, а не сам факт окисления. К детонации приводит образование высокоактивных радикалов, перекиси тут совершенно ни при чём. Наоборот - легкоокисляющиеся УВ служат ловушкой для активных радикалов, обрывая цепи. Они потому легко и окисляются, что дают малоэнергичные радикалы.
-
R-O-CH2-COOH где R - целлюлозное звено
-
Воды не надо добавлять. Жирные кислоты этерифицируются глицерином при нагревании (150-200С) с отгонкой воды. В качестве катализатора обычно соду добавляют (как ни странно), но можно и кислоту. Если КМЦ в натриевой форме, надо её перевести в кислую.
-
В МТБЭ нет изопропилового углерода. Там трет-бутиловый углерод, водорода не имеющий, к образованию гидроперекиси не способный.
-
Восстановительный озонолиз: CH2=CH-CH=CH2 --(1. O3, 2. Zn)--> HCHO + OCH-CHO
-
... - Цианистый натрий только по рецепту. Нет-нет, фотографии вашей тёщи недостаточно!
-
1. 0.5*36.5/1000*100 = 1.825% 2. 0.5*98/2/1000*100 = 2.45%
-
C6H5-CH(CH3)2 + 9O = C6H5-COOH + 2CO2 + 3H2O 2KMnO4 = K2O + 2MnO2 + 3O Берём множитель 3 для второго уравнения и получаем систему: C6H5-CH(CH3)2 + 9O = C6H5-COOH + 2CO2 + 3H2O 6KMnO4 = 3K2O + 6MnO2 + 9O Суммируем: C6H5-CH(CH3)2 + 6KMnO4 = C6H5-COOH + 2CO2 + 3H2O + 3K2O + 6MnO2 Уравниваем справа внутренние реакции: C6H5-COOH + K2O = C6H5-COOK + KOH 2CO2 + 2K2O = 2K2CO3 Получаем: C6H5-CH(CH3)2 + 6KMnO4 = C6H5-COOK + 2K2CO3 + KOH + 3H2O + 6MnO2 Проверяем: слева справа С=9 С=9 H=12 H=12 O=24 O=24 K=6 K=6 Mn=6 Mn=6 Профит!
-
А хрен его знает. Исходя из факта, всегда можно выдуть теоретический пузырь*. Вот так сразу, конечно, не получится, надо репу почесать, шоб не смешно было. * Впрочем, выдуть пузырь вполне практический (0.5, а то и 0.7) - тоже не помешает Корреляция такая - чем больше доноров у углерода, тем стабильнее перекись, тем легче она образуется. Окисление того же кумола, вообще - количественная реакция. Чем более обеднён углерод, тем труднее он окисляется, и тем нестабильнее гидроперекись. Реакция на ней не останавливается, и идёт окисление с образованием более стабильных продуктов. А с третичным углеродом - ваще беда! Окисляется легко, а дальше - только разрыв С-С связи, а это - больно! Вот и накапливает гидроперекись диизопропиловый эфир и кумол.
-
Всё дело только в скорости образования и устойчивости гидроперекиси. Она может получаться быстро, и быть относительно стабильной (как у диизопропилового эфира). Может получаться быстро, и быть малостабильной (как у альдегидов). Ну, и - дальше варианты - медленно и стабильно (как у диоксана), медленно и нестабильно (как у ацеталей). На практике ведь не столь важно, что вещество подвержено окислению, куда важнее - шобы продукты окисления не создавали проблем с ТБ. Поэтому и не педалируется тема перекисей в случае, если их образование не угрожает инородными телами в стекловидном теле МТБЭ - это очень медленно и очень нестабильно. С одной стороны у него метил - трудно окисляющийся (природа у него такая), с другой стороны - трет-бутил, тот - вообще не при делах.
-
Ёмко, лаконично, ни "здрасти", ни "до свиданья". И всё в повелительном наклонении Пишите, Женя, пишите - проверим, подскажем.
-
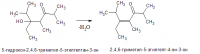
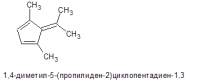
По условию вся эта фигня получается из одно и того же углеводорода. Это может быть, например: Правда, вызывает законное сомнение возможность сохранения кратной связи в одном из продуктов при озонолизе. Но что только ни встретишь в школьных задачах...
-
Лучше не растекаться мысию по древу, а просто сказать, что отщепление идёт по правилу Зайцева. Этот ответ преподавателя устроит куда больше. Не любят преподы слишком умных
-
Ну, это уже не бензин. Это - если надо ратрак завести в Антарктиде, шоб лыжну трассу на леднике королевы Мод расчистить к прилёту Сами-Знаете-Кого.