-
Постов
33677 -
Зарегистрирован
-
Победитель дней
1115
Тип контента
Профили
Форумы
События
Весь контент yatcheh
-
Ясен пень - в таких случаях предварительно модифицируют исходник гетероцикла, а не сам гетероцикл.
-
Если аммиак выделялся - нет там никакого оксида азота 4. Не дружат они. И откуда у тебя, брателло - такая экзотика, как оксид лития? Вот у меня лития - хоть ж.. ешь, а оксида нету. Сам сжигал? И как можно, нюхая аммиак, обнаружить посторонний запах? Чё-то не тычется...
-
Я ж вам толкую - это не химия, это биология. Какая-то микрофлора произросла в грибочках, а газ и запах - следствие её жизнедеятельности.
-
Там очень много веществ, и все - химические. Надеюсь, вы не собираетесь их употреблять в пищу? Впрочем, мы живём в свободной стране. Газообразование в грибочках и появление постороннего запаха - следствие неких бактериальных процессов, если и не ботулинических (сиречь - смертельно опасных), то - однозначно злостных. Откушал отец Онисим грибков, и к обеду преставился...
-
Враньё. Глупое враньё. Кому ты тут очки втираешь?
-
В театре идёт спектакль. В самый драматический момент среди зрителей раздаётся голос: - Врачи в зале есть? Все напрягаются... - Есть! - Как играют, коллега! Как играют!
-
Это с ацетатами. Ацетат-ион - слабый нуклеофил, хлор ему не по зубам. А серебро, в отличие от калий-натрия само участвует в реакции. Любит оно хлор, помогает оторвать.
-
Из ацетата калия этилацетат получить можно - с этилйодидом. А СО2 тут не помощник.
-
Была уже эта задача недавно, ищите в разделе "ПОМОЩЬ"
-
Тут три продукта: 1) B- + H2O BH + OH- CH2=CH-CH2Cl + OH- ----> CH2=CH-CH2-OH + Cl- 2) CH2=CH-CH2Cl + B- ----> CH2=CH-CH2-B + Cl- 3) B- + CH2=CH-CH2-OH BH + CH2=CH-CH2-O- CH2=CH-CH2Cl + CH2=CH-CH2-O- ----> CH2=CH-CH2-O-CH2-CH=CH2 + Cl- где B- - анион основания. Если основание - не анион (например - NH3), то продукт 2) будет солью: 2) CH2=CH-CH2Cl + B ----> [CH2=CH-CH2-B]+Cl- Соотношение продуктов будет зависеть от основности и нуклеофильности основания.
-
Я этот вопрос рассматривал на примере метанола и СО2. Растворимость СО2 в метаноле изрядно больше, чем в воде. Была мысль - а не получится ли диметилкарбонат при насыщении смеси метанола с триметилборатом СО2. Известно, что триметилборат метилирует карбоновые кислоты. И вот такая идея была: CO2 + CH3OH CH3-O-COOH 3CH3-O-COOH + B(OCH3)3 ----> 3(CH3O)2CO + H3BO3 Триметилборат был, метанол был. Имелся и сифон, и даже баллончики к нему. Но тут снабжение осчастливило нас тонной китайского диметилкарбоната по дешёвке, вопрос потерял актуальность, а потом текучка заела. Так я и не поставил этот эксперимент. А было бы интересно. Вот так китайские товарищи душат инновации
-
Да какое там! Я же не стоматолог (ну, может - сорока-тридцатиматолог, не больше) У стоматологов много блестящих острых орудий пыток, которые они прячут от пациентов под салфеткой. Как они называются я не знаю. На ум пришли только названия гравёрных инструментов из "Покровских ворот"
-
Первый раз встречаю химического шовиниста. Обычно физики этим отличаются Лично я предпочту стоматолога, который вообще не знает о существовании азота, но не путает шпицштихель с болштихелем.
-
Ну, видимо получится соль алкилугольной кислоты. С водой СО2 реагирует, образуя угольну кислоту (H2CO3), а со спиртом - алкилугольную (C2H5-O-CO-OH). Она, хоть и не существует в свободном виде, но должна быть более устойчивой, чем угольная. И более сильной, чем уксусная.
-
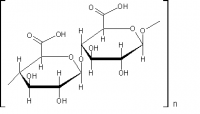
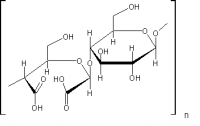
Редактор формул ChemSketch. Я использую бесплатную версию. Она несколько ограничена в функционале, но на 99% удовлетворяет. В случае модифицированных полимеров основная проблема не в том, шоб раскусить химизм модификации - это просто. Проблема в подборе условий модификации, от которых зависят свойства продукта, а это теоретически предсказать сложно, тут надо практически тыкаться. Судя по количеству оптических центров (девять штук) - это природное вещество, выделенное и очищенное. Синтезировать такие суперасимметричные структуры - до этого искусство синтеза ещё не дошло. Тут и Вудворд бы долго репу чесал
-
Обычная азотная кислота плотностью 1.3 не так уж и опасна. Пованивает, но не дымит и ноксами не газит. Если попадёт на руки - смыть водой. В глаза не брызгать. На коже оставляет жёлтые пятна. На одежде - дырки Но для разведения надо знать концентрацию более-менее точно, а для этого - мерить плотность. Нужен ареометр, или пикнометр (а к нему - лабораторные весы). Можно, конечно, развести и руководствуясь указанием концентрации (или плотности) на этикетке, если точность в пределах полпроцента не критична. Скажем, есть 56%-я кислота (d = 1.3 тут уточнить надо). Отливаем 50 мл (это 50*1.3 = 65 г, или 65*0.56 = 36 г чистой кислоты + 29 г воды). Для получения 5%-го раствора надо добавить 36/0.05 - 36 - 29 = 655 мл воды. Получится 720 г 5%-ого раствора. Но лучше, конечно, обратиться к химикам. Азотка в любой лаборатории - вещь не редкая, не дефицитная, не дорогая, не списочная. А раствор приготовить - минутное дело.
-
5%-й азотки в продаже не видел. Если уж её используют - то готовят разведением обычной концентрированной (плотностью 1.3 - 1.4)
-
А что подразумевается под "азотистой кислотой"? Именно HNO2 (гидрат оксида азота(III))? Этой кислоты "в банке" ни у кого нет. Никто её не производит и не продаёт, в виду полной ненужности. Может имеется в виду "азотистоводородная кислота" HN3? Она вполне может использоваться в виде 5%-го раствора для специфических целей. Кислота токсичная и, в более концентрированном растворе - взрывоопасная.
-
Да, чёрт возьми! Слона-то я и не приметил! В каждом звене полимера есть готовые к окислению боковые -CH2-OH группы, способные окисляться NO2. Тогда карбоксицеллюлоза, это Ну, окисляются, скорее всего не все гидроксиметилы, в каком-то количестве... С другой стороны, периодат - классический реагент расщепления гликолей, так что и вариант с частичным расщеплением циклов тоже может иметь место. Есть такой метод анализа полисахаридов - "деградация по Смиту". Получаются при этом альдегидные группы, которые можно доокислить до карбоксилов двуокисью азота (заодно зацепить и часть боковых гидроксиметилов. Тогда появятся и такие фрагменты:
-
Ты там осторожнее с псилоцибами, а то вернёшься из леса с красным знаменем на тачанке с Анкой-пулемётчицей
- 275 ответов
-
- 1
-

-
- свои рецепты
- национальная кухня
- (и ещё 3 )
-
Ога, как тот китаец про Москву: - Хорошо в Москве, тихо, так, спокойно, народу мало... В Казани кролик - деликатес, 350 р/кг - минимум (и это тушка со всеми костями). Телячья вырезка дешевле. А может, тогда - нутрии под мостом живут? Уж больно здоровые...
-
Собственно, плавиковая кислота (водный раствор HF), с этанолом не реагирует. В избытке безводного HF идёт замещение до этилфторида и воды.
-
Общепризнанного стандарта рациональной номенклатуры не существует. Эта номенклатура - паллиатив, что-то среднее между номенклатурой тривиальной и ИЮПАК. Применение имеет очень узкое - только для относительно простых соединений.
-
Логично! Трифторметильная группа - сильнейший акцептор, антимарковниковская группа. Она сильно замедляет электрофильное присоединение.
- 2 ответа
-
- 1
-