Поиск
Показаны результаты для тегов 'Окисление'.
Найдено 50 результатов
-
Альдегид потемнел при хранении. Какая реакция происходит?
FutureDoc опубликовал тема в Органическая химия
Стоял 3-пиридинкарбоксальдегид в стеклянной бутылочке год, стал коричневый, ранее был чуть желтоватый. Какая реакция произошла? спасибо заранее -
Всем привет. Провел я недавно серию опытов по окислению изопропилового спирта в ацетон на разных анодах. Аноды были из свинца и графита. Не на одном из них даже при пропускании теоритического количетсва электричества не были обнаружены следы ацетона. По запаху его нету. Я даже добавлял в электролит перекись водорода(он сернокислый) но выпадения кристалов перекиси ацетона не наблюдается. Вопрос почему? В теории алифатические спирты должны легко окислятся. На практике что то не то выходит. Во всяком случае с ИПСом. Что я мог сделать не так? В работах окисляют спирт на платине, но у меня её нету. Может воспользоваться никелироваными анодами?
-
В задаче 34 ЕГЭ нужно было рассчитать количество сернистого газа, который выделяется при окислении двух твердых растворимых бромидов. При расчёте по условиям задачи оказалось, что концентрированная серная кислота в составе олеума находится в недостатке по отношению к бромидам. Возник вопрос - может ли вода, которая образуется в ходе процесса окисления, захватываться ангидридом и нивелировать исходный недостаток кислоты? Понятно, что в задаче это не учитывали. Но стало интересно, почему это считается очевидным авторами, что даже указаний на пренебрежение вторичными реакциями нет (хотя обычно на это так или иначе в школе указывают). Ведь по всем законам ангидрид - сильный водоотнимающий агент. Разве он не сможет в ходе реакции захватывать образующуюся воду, давая нам серную кислоту и добивая процесс до полного окисления всей соли, даже при исходом недостатке серной кислоты (примерно в 2 раза)? Заранее спасибо!
-
До каких продуктов может окисляться аскорбиновая кислота? Мне сообщили, что с хлоридом железа (III) у аскорбиновой кислоты может по-разному идти реакция. Я знаю только окисление до дегидроаскорбиновой, также образуется FeCl2. Какие ещё могут быть варианты? Может ли окислиться только одна OH-группа? Какой тогда будет продукт с железом?
- 3 ответа
-
- аскорбиновая кислота
- окисление
-
(и ещё 1 )
C тегом:
-
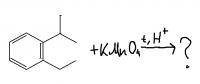
Реакция новокаина с перманганатом калия
Curufinwe Atarinke опубликовал тема в Фармацевтическая химия
Как выглядит уравнение реакции новокаина с перманганатом калия в кислой среде? Вроде достаточно распространённая реакция, качественная реакция на новокаин, а уравнение найти не могу. Какие именно группы окисляются? Какой продукт получается?- 1 ответ
-
- новокаин
- перманганат калия
- (и ещё 2 )
-
как так можно облажаться..купил как то я прозрачный чехольчик с пластмассовыми кнопочками "под хром" на всем известном азиатском сайте. Занимался спортом, потел и думаю дай ка возьму да сменю чехол, снимаю а там темные пятна на алюминиевых кнопках, ничем не оттираются, ужасно обидно. Помогите народ честной, есть у кого нибудь идеи как это очистить?
-
Можно ли окислить уротропин пероксодисульфатом аммония.
Alex Ferrum опубликовал тема в Органическая химия
Можно ли окислить уротропин до N, N, N, N-тетраоксида уротропина по уравнению: (CH2)6N4+4(NH4)2S2O8+16NaOH= 8NH3+(CH2)6(N->O)4+ 8H2O+8Na2SO4 Обычно N-оксиды получают окислением пероксидом водорода третичных аминов в нейтральной или кислой среде. Но пероксодисульфаты неплохо работают в щелочном среде, плюс к тому же уротропин не очень устойчив в кислой среде.- 2 ответа
-
- окисление
- пероксодисульфат
-
(и ещё 1 )
C тегом:
-
Всех приветствую! В 90-е, когда вдруг «цены отпустили», выпускаемый нами клей стал вдруг намного дороже сырья. Мы решили пока «Там» не устаканится, делать клей из отходов резины. «Белую» резину (перчатки, остатки вырубки подошв для сандалий) девулканизовали и делали из неё клеи и даже олифу. Одним из компонентов был гидропероксид скипидара. Купить штатные, типа ГП пинана, уже было нельзя. А отходов ЦБК – скипидаров хватало. Потом в первой декаде 2000-х снова возник вопрос. Теперь уже и с чёрной (автопокрышки, литники). Понадобилось введение усилителей процесса. Но, в целом, процесс этот муторный, хлопотной, хотя и видится рентабельным. И мы бросили. А сейчас ко мне («от имени промышленников») обращается 2-й год человек из ростовской области. Они всё хотят утилизировать покрышки. Но, их они, к сожалению, только как сырьё для котельного топлива рассматривают. Зарубежный скипидар стал очень дорог. Отечественный содержит много серы. Ростовчане присылали мне анализ продуктов термолиза, содержащих лимонен, дипентен. Но, терпенов там мало. Что бы такое найти взамен скипидару? Я вспомнил: в России много олигоизобутиленов (ПИБ). Есть и жидкие. Кислород воздуха при 70-900 С образует ГП ПИБ, устойчивые до 1350 С. Похоже, как и с ГП пинена. Но, вот вопрос: ГП пиненов при распаде давали вербенол. Трудно летучую, но всё же испаряющуюся жидкость. И главное: жидкость! И ПИБ? Он исходно нелетуч. Его ГП распадётся и получится ОН – содержащий олигомер? Во что бы его, если неполезное, то хотя бы не снижающее адгезию и гидрофобность, превратить? Я теперь мало на своё производство надеюсь, но, если вдруг ответвление какое увижу - может и для пользы нашего загибающегося предприятия что сделать смогу? Они всё норовят в топливо. А вдруг чуть в сторону получится? 1. Если не воздух, а персульфат использовать? Одна половинка персульфата .SO3 с основной цепью ПИБ спариться, а вторая ионом уйдёт? А если подкислить? 2. А может мономер какой в среду подбросить? Акриловую кислоту, например? Получится «пришить» АК на место отрыва Н. и образования радикала? Что бы сделать, что бы последствия разрушения ГП ПИБ направить в полезное?
-
Здравствуйте, коллеги, а заодно и с Днем Химика! По работе требуется изохинолин, но как ни странно, в наших краях его ни у кого не нашлось, зато у друга смог подрезать тетрагидроизохинолин. Теперь надо его окислить в изохинолин, но ссылку на хороший способ, желательно с методикой, найти не удалось. Что удалось найти: вроде как иодом советует Эльдерфилд (и пишет, что иод - аффигенный), но кое-где пишут, что иодом полностью не окисляется. Разобраться в этом потоке противоречивой информации не получается, сам я неорганик, органика мне слегка темный лес. Далее изохинолин хочется тоже окислить - до цинхомероновой (3,4-пиридиндикарбоновой) кислоты, а ее уже использовать в качестве лиганда. С этой задачей более-менее понятно, хотя как сказать: в одной книжке пишут, что при окислении марганцовкой в кислой среде получается примесь фталевой кислоты, в другой - смесь цинхомероновой кислоты и ее ангидрида. Второй вариант, конечно, был бы предпочтительнее, на мой взгляд. Но от фталевой кислоты-то понятно, по крайней мере, как избавляться - она в воде почти нерастворима. А вот как ароматизировать тетрагидроизохинолин, пока не ясно. Понятно, что тут нужен какой-то мягкий окислитель типа иода или диоксида свинца в уксусной кислоте, т.е. такой, который боковые цепи при бензольном кольце не рвет. Помогите, а?
- 2 ответа
-
- изохинолин
- тетрагидроизохинолин
- (и ещё 3 )
-
Здравствуйте, товарищи! На досуге занимаюсь пайкой электронных компонентов на печатные платы будущих электронных устройств... Плата печатная - это, своего рода, бутерброд, состоящий из нескольких слоёв диэлектриков и проводников. Первые - из стеклоткани, пропитанной всевозможными смолами, вторые - из медных сплавов, поддающихся лужению и пайке. Слои эти прессуют под высокой температурой и давлением в виде пластин (листов), называемых фольгированными стеклотекстолитами, в данном конкретном случае - типа FR-4. Электронные компоненты имеют выводы изготовленные из различных сплавов (обычно, медных), которые также как и проводники печатных плат должны обладать способностью к лужению и пайке. Связующим звеном в такого рода изделиях являются припои а их неотъемлемыми компаньонами в нелёгком паяльном деле - флюсы. Припои, разумеется, помимо токопроводящих свойств, должны обладать пластичностью и сравнительно низкими температурами плавления. Как правило, промышленные припои являются сплавами олова и свинца (например, типа ПОС-** и им подобные) в различных пропорциях а также дополнительными примесями (такими как серебро, висмут, кадмий, сурьма и пр.), необходимых для обеспечения требуемых физико-механических свойств. Флюсы удаляют оксидные плёнки с поверхностей токоведущих проводников печатной платы и выводов электронных компонентов, тем самым обеспечивая возможность их лужения припоями и, соответственно, непосредственной пайки. Так же благодаря флюсам припои приобретают несравненно лучшую текучесть, благодаря которой они могут протекать в отверстия печатной платы обеспечивая тем самым надёжный механический и электрический контакт выводов с проводниками. Флюсы бывают разные, и классифицировать их можно по многим параметрам и критериям... Как правило, активные флюсы для пайки электронных компонентов - это кислотосодержащие растворы и смеси. Собственно, объяснив что - к чему, прошу вас, товарищи, о помощи! Использую припой ПОС-61 (сплав, содержащий 61% - олова и 38% - свинца, оставшаяся часть - неконтролируемые по содержанию примеси) и активный водосмываемый флюс Multicore HYDRO-X/20 (раствор, содержащий 70-80% - изопропанола, 1-3% - лимонной кислоты и 1-3% - нашатыря, он же - хлорид аммония). После пайки готовое изделие я отмываю (к сожалению) в посудомоечной машине, которая смывает с печатных плат остатки флюса водой нагретой до температуры 60 'C в замкнутом цикле, т.е. она циркулирует по-кругу а подача чистой проточной (равно как и одновременный слив грязной) воды в моечную камеру не осуществляется. После пары-тройки таких циклов отмывки печатных плат в рабочем объёме воды последняя превращается в водный кислотный раствор, из-за которого (по моему мнению) на поверхностях мест пайки (на припое) образуется некий налёт. Быть может, это хлорид олова, или... Чёрт его знает что. Уверенности в этом нет, так как такой "налёт" можно и приписать к окислению поверхности сплава, с образованием микропор, которые невооруженным глазом наблюдаются как потеря металлического блеска и потемнение в различной степени, вплоть до образования чутли не черной поверхности пайки. Быть может, это последствия реакции лимонной кислоты с выделенным аммиаком? Я в растерянности. Слишком много входных параметров для моего недоума. =( Итак, есть раствор C3H8O (70-80%) + C6H8O7 (1-3%) + NH4Cl (1-3%), нанесенный на поверхность сплава Sn (61%) + Pb (38%) и всё это многократно разбавляется и омывается H2O имеющей температуру 60 'C. Пожалуйста, помогите разобраться с этой проблемой. Нужен совет/мнение разбирающихся в этом вопросе: Каким образом можно нейтрализовать кислотность в такой среде, чтоб снизить вероятность появления налёта и окисления мест пайки (потемнения припоя) без возникновения побочных реакций с металлическими поверхностями электронных компонентов? Благодарю за внимание, буду признателен за любую помощь, совет или мнение. С уважением, Георгий Буров.
-
Здравствуйте, уважаемые форумчане. Объясните, пожалуйста, что происходит с медью.В процессе изготовления спирта , в трубу ( ректификационную колонну) набивается медная спм ( проволока). После процесса она извлекается и промывается раствором соли и лимонной кислоты.. на этом этапе внезапно стала образовываться ярко оранжевая вода..( раньше такого не было) эта вода и руки окрашивает .. промыть нереально до чистой воды.. только кипячение с лимонной кислотой и солью останавливает этот процесс..
-
C4H6 ( бутин-1) + K2Cr2O7 + KOH что получается? знаю, что будет в кислой, а в щелочной?
-
Всем доброго времени суток. Возник такой вопрос: какие продукты образуются в результате окисления пропилнитрита пероксидом водорода и перманганатом калия? Также интересует, почему окисление пропилнитрита пергидролем происходит очень бурно, реакция с KMnO4 в водной среде протекает вполне спокойно, а с твердым KMnO4 реакция не идет. Помогите, пожалуйста. Буду рад любому дельному совету.
-
Здравствуйте! Помогите,пожалуйста,с заданием: "Салицин выделен из ивы. Не дает реакции серебряного зеркала, а при окислении дает соединение, при гидролизе которого образуется смесь D-глюкозы и салицилового альдегида (о-гидроксибензальдегида). Метилирование салицина дает пентаметилсалицин, гидролиз которого приводит к 2,3,4,6-тетра-О-метил-D-глюкозе. Напишите уравнения реакций" Спасибо!
-
Всем привет. В свободное время я занимаюсь поиском старинных монет с помощью металлоискателя. Цель моего обращения – получение информации от специалистов в своем деле о процессах окисления медных монет, а точнее о предотвращении окисления и дальнейшего разрушения верхних слоев монеты (патины). За 100-200 лет проведенных в земле, медная монета приобретает патину, это обычное окисление монеты с сохранением рельефа. В разных почвах монеты окисляются по разному, бывает, что ничего уже невозможно разобрать и поверхность монеты настолько окислена, что под этим окислом уже нет рельефа. Речь идет о монетах, которые окислились “правильно”, то есть с сохранением внешнего вида, рельефа. На ютубе много инфы о сохранении и консервации медных монет, кому верить – не понятно. Прокомментируйте пожалуйста один из способов сохранения монеты, который мне показался интересным: Монету нужно поместить на 7-14 дней в дистиллированную воду для того, чтобы соли, которые за века накопились в патине этой монеты растворились в воде и при высыхании не кристаллизовались в патине, тем самым разрывая ее изнутри, со временем из-за этого верхний слой может потрескаться и осыпаться. Далее нужно монету поместить на какое-то время в спирт для обезвоживания. После этого наступает время консервации монеты пчелиным воском. Воск нагревается до жидкого состояния, далее в него помещается монета минут на 5-10, потом вынимается и вытирается тряпкой. Процесс удаления солей из патины и консервации завершен, воск проник в микротрещины и будет защищать монету от воздействия кислорода и влаги, процессы окисления остановлены. Так ли на самом деле? Может быть посоветуете другой способ консервации монеты, если этот сомнительный? Вот фотка монеты, для примера http://coins.su/forum/uploads/2013/03/24/post-27069-0-86461600-1364144925.jpg
-
3-втор-бутилнитробензол (NO2-C6H4-CH(CH3)-CH2-CH3) окислить до нитробензойной кислоты. Какой продукт получается еще с углеродом? Спасибо
-
Окисление этанола 1. рKMnO4+H2SO4 2. CrO3+H2SO4 (такое бывает вообще?) Составить уравнения электронного баланса. Буду благодарен.
-
- 3 ответа
-
- окисление
- перманаганат
-
(и ещё 2 )
C тегом:
-
Температура разложения нитрата меди(2) на оксид меди, кислород и диоксид азота примерно 170 градусаов, а температура разложения нитрата калия примерно 500 градусов. Значит ли это что нитрат меди тоже можно использовать как компонент для пороха, и он также эффективен как и Калиевая селитра?
-
Предстоит опыт: Смешивают формиат натрия, р-ры серной к-ты и перманганата калия. Нагревают на спиртовке. Аналогичные опыты проводят с уксусной, бензойной и щавелевой к-тами. Далее просят написать уравнения ОСУЩЕСТВИМЫХ РЕАКЦИЙ. Подскажите, пожалуйста, какие из реакций будут осуществимы (реакции сама напишу).
-
Всем доброго времени суток! Случайной наткнулся в сети на карандаши, у которых вместо грифеля используется металлический стержень. В дешевых вариантах этот "грифель" состоит по большей части из свинца. Что, согласитесь, не есть хорошо, особенно если потенциальный пользователь имеет привычку грызть карандаш. В дорогих вариантах, состав рабочего сплава не раскрывается. Судя по описанию маркетологов, сплав быстро окисляется на воздухе, и на бумаге остается именно слой оксида. Преимущество таких писательных устройств в их относительной долговечности. Собственно вопрос, из чего можно сделать подобный грифель самому? Из требований - безвредность для человека, относительная доступность и дешивизна материалов. PS В качестве варианта я рассматривал оловянно-индиевый припой или чистый индий, который в теории можно достать с ebay. Чистое олово, как и серебро оставляет слишком слабый след
-
Здравствуйте, всем! Просветите дилетанта. Есть окисленные молибденовые полоски - разной степени посинения или просто потемневшие или же, пожелтевшие: №1 №2 Бывают и такие: №3 Можно ли очистить поверхность такой молибденовой полоски с сохранением механических свойств? Желательно, чтобы это выглядело примерно так: №4 или хотя бы: №5 Правда, на этих фото баланс белого выставлен по разному, но смысл, всё же, понятен. Если такое возможно, предложите, пожалуйста, вариант не требующий специальных знаний. Спасибо.
-
Товарищи химики органики, не знакомы ли вам примеры, когда сульфат выступает в качестве окислителя органических соединений? Не в составе серной кислоты, а в нейтральной или щелочной среде. Мне знакомы примеры окисления органического вещества и сульфитом и персульфатом - я это даже делал. А сульфатом? А то у меня кабен в автоклаве окисляется. Кто виноват? Медь II сама по себе так отработать не могла, так как она не донор кислорода. Что помог? Следы воды или сульфат?