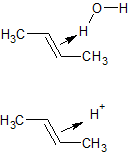-
Постов
34061 -
Зарегистрирован
-
Победитель дней
1124
Тип контента
Профили
Форумы
События
Весь контент yatcheh
-
Получается буферный раствор из смеси карбоната и гидрокарбоната. Для pH буферного раствора справедливо соотношение: pH = pK2 − lg([NaHCO3]/[Na2CO3]). Для угольной кислоты pK2 = 10.33 lg([NaHCO3]/[Na2CO3]) = 10.33 - 10.5 = 0.17 [NaHCO3]/[Na2CO3] = 1.48 Концентрация гидрокарбоната равна концентрации исходной кислоты [NaHCO3] = 0.2 [Na2CO3] = 0.2/1.48 = 0.14М Количество карбоната = 0.2*(0.2 + 0.14) = 0.068 моль Масса = 0.068*106 = 7,21 г P/S/ На вашем месте я бы проверил выкладки на предмет чисел. Я только до десяти хорошо считаю.
-
Реактив Х - сероводородная вода. Вещества - соли серебра, ртути(2), цинка. Все - бесцветные. Первые два дают чорный сульфид в осадке, последний - белый сульфид. Соль серебра даст белый осадок с хлоридом натрия. Соль цинка даст осадок гидроксида, который растворится в избытке щёлочи. Соль ртути(2) не реагирует с хлоридом, и с щёлочью даёт осадок, нерастворимый в избытке щёлочи.
-
Окислится, куда он денется. Есть такая технология - процесс Дикона называется. Окисление HCl до хлора на хлорной меди при 400С 4HCl + O2 -(CuCl2)-> Cl2 + H2O Ясен пень, что каталитический цикл проходит через окисление хлорной меди с последующей регенерацией. CuCl при прокаливании на воздухе будет ещё легче окисляться. 2CuCl + O2 = 2CuO + Cl2 или, как минимум 2CuCl + 1/2O2 = CuO + CuCl2
-
А если подогреть - то до бензойной кислоты.
-
На кой чёрт получать борный ангидрид, если реакция идёт в воде? С таким же успехом можно просто нагреть борную кислот=у с лимонной. Да и не цитрат там получается, но это - не суть важно.
-
На кой чёрт там вакуум? Сначала оттяните хвостовик подлиннее, но не слишком тонкий, потом залейте тудой эфир хоть шприцем. Нагрейте эфир до кипения в тёплой воде, перенесите в ёмкость с холодной водой, и тут же запаивайте хвостовик.
- 67 ответов
-
- диэтиловый эфир
- хранения лвж
- (и ещё 4 )
-

Почему галогеноводороды получают из сухих солей?
yatcheh ответил Anastasia2009 вопрос в Вопрос-ответ
Так то серка. А то - фосфорная, да ещё 85%-я. -

Почему галогеноводороды получают из сухих солей?
yatcheh ответил Anastasia2009 вопрос в Вопрос-ответ
Ясен пень - греть надо. А потом ещё сушить. Просто серняги не было, только на осушку хватало, вот и пришлось экспериментировать. -

Почему галогеноводороды получают из сухих солей?
yatcheh ответил Anastasia2009 вопрос в Вопрос-ответ
Тоже работает, проверено лично. Но хреново. Работает хреново. А проверено хорошо -

Почему галогеноводороды получают из сухих солей?
yatcheh ответил Anastasia2009 вопрос в Вопрос-ответ
Товарищи химики! Кто-нить может ответить на этот вопрос? Я уже трижды пытался что-нить написать, но - нахожусь в полной растерянности. Вопрос-то - гроша выеденного не стоит. А начинаешь формулировать - бред какой-то получается. -
Разумеется - В) Катализатор понижает энергию переходного состояния, что приводит к ускорению реакции. В чём и состоит смысл его применения. Переходное состояние может иметь радикальную природу R-CH*-CH*-R или ионную R-CH+-CH--R. В обоих случаях возможно восстановление пи-связи в другой конфигурации.
-
Нет. Это - чисто радикальная реакция. Нитрид должен реагировать на замещение, нуклеофильно - азотом, или электрофильно - катионом металла. В последнем случае генерируется трихлорметил-катион. Проблема тут в растворителе. Для нитридов хорошего растворителя нет. Для амидов - жидкий аммиак
-
Если правильно записать, то это будет NaNCO. В реакциях замещения все эти соли как изоцианаты реагируют. 2NaNCO + COCl2 => O=C=N-CO-N=C=O + 2NaCl Карбонилдиизоцианат, если мне склероз не изменяет - вполне себе стабильная жижа.
-
С такими реакциями - к Руслану Шапирову. У меня это уравнение вызвало желание немедленно махнуть стакан водки
-
Нет жидкого - газообразный надо юзать. Уротропин, оно, конечно - интересно, но там ведь формальдегид ещё есть, вещество, мягко говоря - не слишком инертное. Вот Гексаметилдисилазан как замена жидкому аммиаку ещё как-то тянет. Хотя у него нуклеофильность и понижена, но зато кипит он высоко (как бы не 120С). Я пытался его ввести в реакцию с сульфурилхлоридом в видах получить бис(хлорсульф)имид. Но не вышел каменный цветок, ботва какая-то получилась невнятная, походу хлоры сыпались беспорядочно.
-
А чем он поможет? Аммиак связать ещё сильнее? Зачем тут аммиак в виде соли вообще?
-
С водным аммиаком, скорее - первое будет. С безводным - мохбыть и хлорциан, цианамид опять же, и еже с ними. Ну, это уж совсем фантастически выглядит... Шобы протонированный аммиак, аммоний, да с ЧХУ как-то реагировал, нет, это фантастика.
-
Нет. Это очень хорошие уходящие группы, но - совершенно никакие нуклеофилы.
-
Да, в этом дело. Йодид-ион и нуклеофил сильный, и уходящая группа - английская - уходит быстро, молча, и не прощаясь. Но это не волшебная таблетка. Там ускорение не такое, чтобы - ах! - всё из колбы выпрыгнуло и по лабе поскакало ))
-
Водная? У вас что - оконное стекло? Я же вам не предлагаю 50%-й KOH кипятить. 10-15% - максимум. А такую жижу пирекс переживёт, даже при кипячении. По мере уменьшения органического слоя можно добавлять щёлочь, чтоб ему жизнь малиной не казалась.. А по мере накопления этиленгликоля и реакция будет ускоряться.
-
Для гидролиза лучше водную щёлочь взять. Если долго кипятить смесь -гидролизнётся, куда он денется. Тем более, что там только первый галоген упирается, второй, да ещё в бета-положении отлетает быстрее. Можно межфазник добавить, только не аммонийный, а типа крауна.
-
Идиот. Эти комплексы в растворе существуют только в избытке карбоната. Впрочем, всё, я больше это существо не комментирую.
-
Около 70. Хм... Даже не знаю. Как-то не задумывался... Вот, блин, умеешь ты вопрос задать - ни дать, ни взять!
-
В первом случае в скоростьлимитирующей (самой медленной) стадии участвует молекула воды. Образующийся π-комплекс через ряд превращений переходит в продукт. Поскольку водород в молекуле воды - слабый электрофил, реакция в целом идёт очень медленно. Участие воды в самой медленной стадии и предполагает зависимость скорости от концентрации воды. Во втором случае скоростьлимитирующая стадия - протонирование двойной связи. Протон - сильный электрофил, и реакция в целом идёт быстрее. В этом случае скорость реакции зависит только от концентрации катализатора (кислоты), вода в самой медленной стадии не участвует.