-
Постов
34259 -
Зарегистрирован
-
Победитель дней
1131
Тип контента
Профили
Форумы
События
Весь контент yatcheh
-
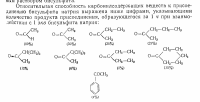
Трёхмерное связующее, увеличивающее "сетчатость" полимера.
-
- Анисовую! - Ну, анисовой нет... Я говорю - анисовой нет, "Столичная"! ©
-
Вопрос очень спорный.
-
Если намагничивать иглу против поля - потребуется больше енергии, чем при намагничивании по полю. Разность энергии выделяется при повороте иглы в виде тепла, выделяющегося в подвесе. Естественно, энергия иглы, направленной против поля, больше. Если намагничивать иглу в отсутствие внешнего поля, то внесение той иглы во внешнее поле потребует разной энергии, в зависимости от её ориентации.
-
А у ТС про экскременты - ни слова. Если у вас экскременты были - то ето херня. Алюминий не чистый. Сплав. Сыпется какой-нить марганец.
-
Хрень какая-то. Размазал сопли по стеклу грязным пальцем. Выделение водорода - побочная реакция, с выделением меди никак не связанная. Прямая реакция алюминия с водой (что до тебя, уважаемый, пытался донести коллега акула). Оксосоли алюминия в растворе не удерживаются. В осадке будет медь и гель гидроокиси алюминия, в растворе - натрий, алюминий и остатки меди в виде смеси сульфатов и хлоридов. А хлоркупраты тут вообще ни при чём.
-
Да уж... "Таблица свыше нам дана, замена разуму она" Я на практике только с бисульфитными производными альдегидов имел дело. Возможно, я был излишне эмоционален, но не более, чем вы, с утверждением Практика - критерий истины, тут я согласен. Но нужны пруфы... "Мамой клянусь!" - это не пруф Сканы было бы интересно глянуть, закиньте на yatcheh@yandex.ru
-
Алюминий будет улетать в виде субхлоридов (при 1200С равновесие Al + AlCl3 2AlCl2 на 100% сдвинуто вправо).
-
Спирт ето этиловый, только денатурированный по самое нехочу. Хотя местные менделеевы могут и метанола вальнуть. А его так и получают. Из толуола и сульфурилхлорида (или хлорульфоновой кислоты). Можно сернягой толуол просульфировать, выделить сульфокислоту и пятихлористым фосфором её.
-
Возьмите лучше водку. Только - не очень дорогую. Что-то вроде "Валюты". Можно ещё на ИПСе раствор сделать - тоже катит. Говорю вам, как практикующий технолог
-
Нагревание - это опционально. Так очищают растворы солей, выпадающих в осадок при охлаждении (в чём, собственно, и заключается смысл перекристаллизации). Если предполагается получение стабильного раствора с последующим упариванием, ГОРЯЧЕЕ фильтрование - разумеется, излишне.
-
Знатные горшки! Я всегда говорил, шо самые высокие технологии в химии - ето ведро и лопата. Если синтез нельзя провести при помoщи только этих девайсов - инженера-разработчика надо гнать в шею!
-
KBr + H2SO4(H2O) ----> KHSO4 + HBr CH3CH2OH + HBr ----> CH3CH2-Br + H2O Если вальнуть конц сернягу к сухому бромиду, то, во-первых, бОльшая часть HBr просто улетит: KBr + H2SO4 ----> KHSO4 + HBr↑ , поскольку ему не в чем будет растворяться, а часть его ещё и окислится серной кислотой: HBr + H2SO4 ----> SO2 + H2O + Br2 (не уравнено) И получится вонючая коричневая ботва, от которой никакого толку не будет.
- 1 ответ
-
- 1
-

-
- галогеналканы
- выход продукта
-
(и ещё 2 )
C тегом:
-
Охота пуще неволи. Я это проделывал с растворами неких солей в неких растворителях. Ну надо было - до зарезу
-
Оставим это на совести аспиранта
-
Прибор для этого - набор лабораторных ареометров. Вот, только он - бесполезен без таблиц плотности растворов вашей соли в вашей кислоте. Хотите по плотности определять - ищите таблицы. Может кто-нить, когда-нить, где-нить их и публиковал... Другой подход - самостоятельно такую таблицу составить. Берёте кислоту, соль, делаете максимально концентрированный раствор, а потом, разбавляя его, меряете плотность. Периодически . Получаете точечную диаграмму, обрабатываете её в доступном графическом пакете для сглаживания и интерполяции, и пользуетесь полученным уравнением, связывающим плотность и концентрацию соли.
-
Не получится ангидрид в присутствии HCl (а от него никуда не денешься). Ангидрид с HCl реагирует на ура, с образованием смеси кислоты и хлорангидрида. Для получения ангидрида надо не кислоту брать, а соль ейную. R-COONa + SCl2 ----> (R-CO)2O + NaCl + SO2 + S
-
Да, тут простое уравнивание нужно. Сами реакции совершенно однотипны.
-
Это не совсем окисление. Это озонолиз. В присутствии цинковой пыли - восстановительный озонолиз. Из пара-ксилола получится две молекулы 2-оксопропаналя (CH3-CO-CHO) и одна молекула щавелевого альдегида (OHC-CHO)
-
Если предполагается получить оптически активный продукт, то нужен оптический индуктор. Например, можно провести реакцию в оптически активном растворителе. При этом один из изомеров будет преобладать. Можно разделить рацемат, скажем - хроматографией на оптически активном носителе.
- 5 ответов
-
- стереоизомеры
- стереоизомерия
- (и ещё 2 )
-
Так замещение у третичного углерода.