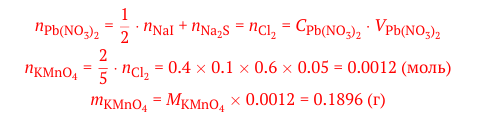Поиск
Показаны результаты для тегов 'Задача'.
Найдено 283 результата
-
Вещество А содержит 0,261 углерода, 0,464 кислорода и 0,203 азота по массе. Известно, что вещество А образуется при взаимодействии гидроксида диамминсеребра(I) с веществом Б. На основании данных задачи: 1)установите молекулярную формулу органического вещества А; 2)приведите его структурную формулу, которая однозначно отражает порядок связи атомов в молекуле; 3)напишите уравнение реакции взаимодействия вещества Б с гидроксидом диамминсеребра(I).
-
Смесь искусственного воздуха состоит из кислорода и гелия. Эта смесь легче кислорода в 3 раза. Нужно найти объемные доли кислорода и гелия. Помогите, пожалуйста, решить...у меня ощущение недостающих данных🤔
- 1 ответ
-
- задача
- объёмные доли
-
(и ещё 3 )
C тегом:
-
Определите массу перманганата калия который при реакции с избытком соляной кислоты выделит достаточно хлора для реакции с 50 мл раствора йодида и сульфида натрия. Для полного осаждения анионов S2– и I– в 1 мл этого раствора требуется 0.6 мл 0.1 M нитрата свинца. В решении предлагается такой вариант (рис.1) , который не ясен с точки зрения логики, я решал таким образом (рис.2) с учетом того, что у нас соотношение при осаждении иодид ионов другое. Какое в итоге решение является верным?
- 1 ответ
-
- неорганика
- задача
-
(и ещё 2 )
C тегом:
-
Здравствуйте, помогите, пожалуйста. Мне кажется, что в условии ошибка, либо я чего-то не понимаю. Вот условие: Неоконченная электронная формула атома этого элемента имеет вид: 1s22s22p63s23p6…… Известно, что 0,075 моль элемента имеет 67,758·10²³ недостающих электронов. 1) Напишите полную электронную конфигурацию атома данного элемента.
- 4 ответа
-
- неорганика
- общаяхимия
-
(и ещё 1 )
C тегом:
-
Соединение Х1 состава оптически активно, хорошо растворимо в воде (раствор окрашивает лакмус в красный цвет) и при сильном нагревании переходит в соединение Х2, которое не обладает оптической активностью, умеренно растворимо в воде (раствор имеет кислую реакцию) и намного активнее вступает во взаимодействие с перманганатом калия, чем Х1. При окислении разбавленным раствором хромовой кислоты Х1 превращается в Х3, которое не взаимодействует с перманганатом калия, а при действии йода в растворе щелочи дает желтый осадок. Определите молекулярные и структурные формулы веществ Х1 – Х3, если известно, что Х1 содержит 42.15% углерода и 7.7% водорода по массе. Запишите уравнения всех указанных реакций.
-
14.(247а) С какими из перечисленных соединений: Н2О, О2, N2, КОН, Н2SО4 (разб. и конц.), S будет реагировать металл Mg. При необходимости укажите условия проведения реакции.
- 14 ответов
-
- общая химия
- 1 курс
-
(и ещё 2 )
C тегом:
-
Образец тригидрата нитрата меди (II) разделили на две части так, что общее число электронов во второй части оказалось больше общего числа электронов в первой части в 2 раза. Первую часть кристаллогидрата прокалили до постоянной массы. Выделившиеся газы собрали и охладили, их объем при нормальных условиях составил 14 л. Из второй части кристаллогидрата приготовили насыщенный раствор при 40°C (растворимость кристаллогидрата при 40°C составляет 381 г в 100 г воды) и провели электролиз до тех пор, пока на инертном аноде не выделилось в 2,5 раза меньше газа, чем объем газов, выделившихся при разложении первой части кристаллогидрата. Вычислите массовые доли веществ, находящихся в растворе после электролиза. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
-
- егэ
- электролиз
-
(и ещё 3 )
C тегом:
-
Помогите, пожалуйста, решить задачу: Определите какой объем 10%-ного раствора метабората кальция (ρ= 1,04 г/cм 3 ) можно получить из 52 г бора?
- 2 ответа
-
- задача
- метаборат кальция
-
(и ещё 1 )
C тегом:
-
Начала учить 10 класс (заранее). Задачка такая: При разложении иодида неизвестного металла, массой 0,394 г на раскаленной проволоке, ее масса увеличилась на 0,06 г. Иодид какого металла был взят? Решила попробовать "наугад". Мне сразу показалось. что металл здесь с маленькой молярной массой. Первая мысль - натрий (ибо он самый "простой" и популярный в школьных задачках). Подставила: 1) М(NaI)=127+23=150 2) v(NaI)=0,394\149=0,00263 3) Уравнение: 2NaI=2Na+I2 4) m(Na)=0,00263*23=0,060 Вроде бы все получилось. Но когда я спросила на Маил Ру, мне ответили, что это иодид циркония (ZrI4). Кто прав? И где я ошиблась? Заранее спасибо за помощь!
-
40 литров образца азота (г), содержащего SO2 (г) в качестве примеси, пропустили через 3% раствор H2O2. SO2 превратили в H2SO4 : SO2 + H2O2 = H2SO4 25 мл NaOH с концентрацией 0.01 моль/л было добавлено в раствор, избыток щелочи был подвергнут обратному титрованию с 13.6 мл HCl с концентрацией 0.01 моль/л. Посчитайте количество SO2 в миллионных долях (т.е. мл SO2 на 106 мл пробы), если плотность SO2 равна 2.85 г/л. Помогите, пожалуйста, с решением данной задачи, общий ход действия понятен, однако довести задачу до ума не могу, не знаю где применить 3%. Также прошу помочь с разъяснением подсчета ppm (миллионные доли). Это примерный перевод задачи на английском языке, прикрепляю оригинал:
- 8 ответов
-
- ppm
- титрование задачи
-
(и ещё 2 )
C тегом:
-
При полном сгорании 2,66 г некоторого вещества получилось 1,54 г углекислого газа и 4,48 г воды. Нужно решить задачу и определить простейшую формулу вещества.
-
Абсолютно не имею понятия, как решать эти задачи... Буду рад, если поможете. Задание №1: Сепаратор подшипника из латуни марки ЛЦ40С на основе меди и цинка с добавлением свинца и сурьмы покрыт слоем кадмия. 1. Определите тип покрытия относительно основного металла. 2. Рассмотрите два возможных варианта протекания процесса коррозии изделия при частичном нарушении покрытия (царапина): а) в атмосферных условиях; б) в растворе разбавленной серной кислоты. 3. Для каждого случая составьте уравнения электродных процессов. 4. Определите продукты коррозии. 5. При кислотной коррозии определите металл, на котором происходит локализация катодного процесса. Задание №2: Резьбовое крепежное изделие из инструментальной стали на основе железа, содержащей кобальт и медь, покрыто цинком. 1. Определите тип покрытия относительно основного металла. 2. Рассмотрите два возможных варианта протекания процесса коррозии изделия при частичном нарушении покрытия (царапина): а) в атмосферных условиях; б) в растворе разбавленной серной кислоты. 3. Для каждого случая составьте уравнения электродных процессов. 4. Определите продукты коррозии. 5. При кислотной коррозии определите металл, на котором происходит локализация катодного процесса.
-
Для синтеза сложного эфира взяли по 30 мл этанола и уксусной кислоты (пл. веществ 0,789 и 1,049 г/мл соответственно) и 1 мл 98%-го раствора серной кислоты (пл. 1,83 г/мл). После установления равновесия сложный эфир отделили. К оставшейся смеси добавили воды до общего объема 100 мл. Для нейтрализации 10 мл полученного раствора потребовалось 40,2 мл раствора гидроксида натрия с концентрацией 0,5 моль/л. Вычислите, с каким выходом (%) прошла реакция этерификации.
- 3 ответа
-
- задача
- сложный эфир
-
(и ещё 1 )
C тегом:
-
Здравствуйте, помогите, пожалуйста, решить задач по органической химии! Некоторую порцию изопропилпропионата подвергли сначала кислотному гидролизу, а затем щелочному. Масса спирта в первом случае оказалась в 3 раза больше массы спирта, полученного в ходе щелочного гидролиза. Полагая, что щелочной гидролиз прошел с выходом 100%, рассчитайте выход реакции (%) кислотного гидролиза.
- 1 ответ
-
- сложный эфир
- задача
-
(и ещё 1 )
C тегом:
-
Решить задачу в рабочей тетради. При электролизе 400г 30% р-ра гидроксида натрия на катоде выделилось 5,6л (н.у) газа. Найти массовую долю оставшегося в-ва в электролизере и объем газа (н.у.)
- 7 ответов
-
- электролиз
- naoh
-
(и ещё 5 )
C тегом:
-
Задача определить состав исходной смеси в объемных долях
alex.271 опубликовал тема в Решение заданий
Помогите, пожалуйста! Один моль смеси изомерных бутинов пропустили через аммиачный раствор оксида серебра. В результате выпал осадок, содержащий 22,575*10^24 протонов. Определите состав исходной смеси в объемных долях. -
При взаимодействии 53,4 г. аланина и 36,8 г. этанола получили 59,67 г. эфира. Определите выход этого продукта.
-
До какого объема надо разбавить раствор, приготовленный из фиксанала, содержащего в ампуле 0,2000 моль эквивалентов иода, чтобы получить раствор с концентрацией 0,5000 моль/л (f = 1/2)?
-
Який об'єм 0 ,1 н розчину KMnO4 піде на титруванняа)0,15 г Na2C2O4б) наважки руди, що містить по масі 43% заліза
-
- задача аналитика
- задача
- (и ещё 21 )
-
-
Mecь cульфида цинка и cульфида мeди растворили в соляной кислоте и выделилось 6,8 г газа. Абсолютно такую же CMecь растворили в горячей азотке (конц) и выделилось 89,6 л газа н. у.. Нужно найти массовую долю серы как элемента в исходной cmecи. ZnS + 2 HCl = ZnCl2 + H2S CuS + 8 HNO3 = CuSO4 + 8 NO2 + 4 H2O ZnS + 8 HNO3 = ZnSO4 + 8 NO2 + 4 H2O Массу и количество всего найти мне мозг позволяет, а вот связать вопрос и данные - нет. Из чего искать то w(S)?
-
-
5кг уголь, он состоит на 0,9 С , 0,05 шлак и 0,05 вода, которая при сгорании выделяется пара.шлак не считается в реакции. Воздух состоит на 0,2 из О2 и на 0,8 из N2. Исходите из того, что во время сгорания часть О2 делится пополам и мы как продукт получаем СО2 - 0,9 и СО - 0,1(данные в n). Диаметр камина (откуда выходят газы) с диаметром в 8.0см. Температура в камине 120 градусов и давление 1005мбар. Время сгорания 3 часа. а)массу и n посчитать на С и Воды (мои расчеты С=4500г/n=375 Вода=250г/n=13,8?)б)написать реакцию и нормировать коэффициенты на 1 по отношению к С(напишите, я бы проверил)в)n для продуктов сгорания(СО=22,3 и СО2=255,5?) и для О2(124,9?) для этой реакцииг)n для сгорания воздуха (как я понял ето О2 и Н2 вместе)(624,5?), который для реакции нуженд)n для выделяющего газа (инкл. Вода) (263,7?) е)общий обьем для выделяющего газа (в м в кубе), средний расход воздуха(в литры про сек.) и средний поток воздуха в дымовой трубе (в условиях разного давления и температуры) - а вот здесь я хз как сделать и нам не объясняли ( Буду очень благодарен за вашу помочь, если что-то не понятно то пишите(условия задачки переводил на русский, потому сорри)
-
Производство бытовой химии, необходимо произвести лактат триэтаноламина (из молочной кислоты и триэтаноламина) Необходимо узнать время реакции, точное кол-во вводимых компонентов/полученных компонентов. Пишите в вацап +79111637385 (Кирилл) договоримся о цене.