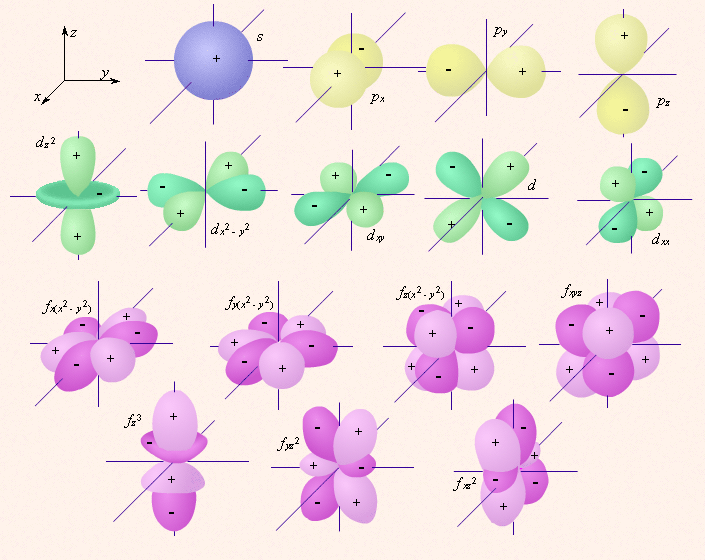-
Постов
4590 -
Зарегистрирован
-
Посещение
-
Победитель дней
19
Тип контента
Профили
Форумы
События
Весь контент Shizuma Eiku
-
Да уж, полный бред Основы общей химии Б.В. Некрасова т.1, стр. 229 двухтомника который выложен в интернете: Неужели натрий всегда нульвалентный, как и хлор в соединениях содержащих ион Cl-? Обратимся к определению из Большой Российской энциклопедии: Т.о. на самом деле валентность это некоторая химическая связь, без указания её типа; это логично - сначала появилось понятие валентности, а лишь гораздо позже, с изучением структуры атома, появились теории возникновения химической связи и разделение её на типы. Тип связи в тех или иных случаях может быть под вопросом, а валентность всегда очевидна т.к. известно соотношение атомов в молекуле. Именно поэтому приведенное определение привязано в т.ч. к соединениям с другими элементами. В азотной кислоте азот безусловно пятивалентный - он образовал 4 ковалентных и 1 ионную связь, как описано у Некрасова выше, суммарно связей 5. В HN3 два атома азота трехвалентные, один пятивалентный, он дает ей некоторые свойства, схожие с азотной кислотой. В Википедии, кстати, много лет висела схожая ошибка - в статье про валентность была описана ковалентная связь, наверное людей путает корень у слов. Степень окисления это формальная величина для уравнивания ОВР. Не могу удержаться - вот у нас есть нитрит, в нём азот трехвалентный однозначно; этот нитрит был разложен и получена смесь NO и NO2, в первом азот двухвалентный, во втором четырехвалентный. Диоксид азота был окислен и из него получена азотная кислота/ нитрат/ азотный ангидрид (почему бы и нет, можно озон использовать) - азот ведь окислился, его валентность явно превысила IV. Или произведено восстановление азотной кислоты, медью например, медь окислилась, азот восстановился и образовалось соединение четырехвалентного азота, NO2. Явно что в азотной кислоте валентность азота была выше IV. Как такие превращения можно игнорировать только потому что неправильно понял теорию теория сказала?
-
Уже много раз давали ответ на этот вопрос - вероятность обнаружения электрона. Вероятность обнаружения электрона не следует понимать в прямом смысле, что исследователь будет обнаруживать электрон, это просто формулировка - если смущает именно это. Вообще такого нет. Выше я уже несколько раз это писал, повторюсь еще раз - электрон это не шарик, у него есть свойства волны. Для примера можно взять волну от wi-fi - разве она нигде не пребывает только потому что не находится в точке на 100%? Как раз наоборот, сигнал wi-fi становится доступен нам через более-менее толстые материальные преграды именно потому что длина его волны аж 12.5см, наличие интернета принятого через него очевидно. Из неправильно использованной логики. Предлагаю просто подумать над этим вопросом - а до какого предела, собственно, можно реально измерять координаты, импульс, энергию, время и т.д. При правильном ходе мыслей 100% выйдешь на принцип неопределенности С такими формулировками получается как будто бы материалисты отрицают существование волн. Большинство участников форума да, используют научную терминологию. Так, почему это электроны объединились за счет спина/ своих спинов, откуда вообще взялась такая мысль? Проблема в том, чтобы понять природу сильного, слабого, кулоновоского и даже запутанных взаимодействий. Согласен, что природа спина также требует исследований. К счастью, уровень химической связи отлично изучен и понят, это несложный предмет т.к. типов химической связи мало. Смтр. принцип неопределенности. При попытке изучить объекты микромира так, как мы изучаем объекты макромира, адекватный результат получить невозможно; скажем, узнать координаты покоящегося электрона нельзя, даже если бы существовало всезнающее божество (а учитывая масштабы Вселенной в ней можно ожидать найти почти что угодно), то и оно бы их не знало. Вопрос не вполне понятен, но электроны, вообще говоря, довольно охотно покидают внешние уровне многих атомов, склонных к ионизации. В случае металлов, их высокая электропроводность обусловлена именно такими свободными электронами. Сами атомы от этого не разрушаются т.к. ядро (а вместе с ним масса атома и заряд ядра) остаётся прежним. Электроотрицательность это свойство атома к присоединению электронов, а атомы не разрушаются от потери либо присоединения электронов. Силы Кулона работают и для атомов, просто они гораздо слабее чем другие взаимодействия в атоме.
-
Пятая связь в пятивалентном азоте не ковалентная, а ионная; на самом деле, в последнее время она довольно часто именно такой и изображается в структурных формулах, с делокализацией, например, отрицательного заряда между двумя кислородами. Тут скорее интересно, как можно додуматься до отрицания существования пятивалентного азота при том что при обычных условиях он куда устойчивее чем четырехвалентный или трехвалентный, не говоря уже что нитраты и азотная кислота всегда где-то рядом. Валентность отражает реальные химические связи, степень окисления величина формальная; ясное дело что они не связаны. Она может быть принята любой. Конечно, у азота в гидразине при желании СО можно принять и -1, но по-моему, она неудачная т.к. в таком случае у водорода степень окисления получается дробной N-12H+0.54. В молекуле азотистоводородной кислоты разные расстояния между атомами азота; входящие в состав молекулы атомы азота явно не являются равноценными и по химическим свойствам - с одной стороны, HN3 проявляет свойства пятивлентного азота когда образует с HCl смесь, похожую по свойствам на царскую водку, с другой, проявляет свойства трехвалентного азота, когда образует с органическими оксосоединениями амины.
-
Это общая реакция для всех веществ в которых есть Cl+ в нейтральной или кислой среде, Cl-+Cl+->Cl2. Она представляет главную проблему при работе с гипохлоритами т.к. удалить хлориды из них очень трудно. Сразу по нескольким направлениям, от ацетона останутся рожки и ножки, думаю что основным продуктом будет хлорпикрин т.к. он часто образуется при одновременном деструктивном хлорировании и нитровании органики. Его еще получить надо сначала как-то... По-серьезному, реакции органических веществ с такими реагентами нужно проводить в разбавленных растворах в подходящем инертном растворителе. И не факт что CCl4 не будет нитроваться ClNO3 до хлорпикрина. CF4 при температуре жидкого азота как среда был бы отличным вариантом, вот в таких условиях что-то интересное получить можно.
-
Эта реакция идет выше 100 оС, причем при щелочном рН. Если уж сравнивать SnCl2 с гидразином, то первый окисляется и при обычной температуре. Интересно, а что если хромпик использовать? Дихромат эффективное средство против коррозии стальных труб. Я бы выбрал ник связанный с котиками, но уж какой есть, такой есть. В молекуле HN3 один атом азота пятивалентный, по сравнению с гидразином, азот там куда более окисленный.
-
Учитель просто заинтересовал детей своим предметом, это не говорит что они будут знать и понимать физику школьного курса. По большому счету, дети должны учить предметы и без заинтересованности в них т.к. учеба это их работа, а харизматичных учителей меньшинство, на всех их не хватит. Я ответил про заряды - кулоновские силы слабы в масштабах атома и электронов. Вообще нет. Чтобы понять принцип неопределенности математика не нужна. Поведение электрона в пространстве атома выражается вероятностью; запрет на 100% вероятность пребывания электрона в точке следует из принципа неопределенности. Атомная орбиталь - область пространства с высокой вероятностью обнаружения электрона (90% или 95%), форму сферы она имеет далеко не всегда, в большинстве случаев форма орбитали отлична от шарообразной: В атоме у электрона нет траектории по которой он движется, есть лишь вероятность обнаружить его где-либо. А в чём проблема-то?
-
Действительно, причем тут кислород при восстановлении или окислении спиртов или фенолов, вот горе-то какое, что в реакциях вроде 2RCH2OH+2HI->2RCH3+H2O+I2 или окислении гидрохинона/восстановлении хинона, кислород не окислитель, ведь он не меняет степень окисления... На самом-же деле, степень окисления - величина формальная и может быть принята любой; при соблюдении прочих правил уравнивания, ОВР уравняется То что кислороду при расстановке степеней окисления чаще всего ставится -2, не означает, что он присоединил два электрона и образовал ионную связь с зарядом -2 на себе, вообще говоря, ион О-2 большая редкость. Соответственно, неверно считать что если кислород не поменял степень окисления то молекула не окислилась. Например, в случае восстановления спиртов, подразумевается удаление кислорода путем восстановления гидроксигруппы, что и происходит; в случае восстановления хинона наоборот - удаления кислорода из молекулы не происходит, но сама передача электронов - на вполне реальном, а не на формальном уровне - происходит через них, когда электрон присоединяется к кислороду О=С< с образованием аниона. Яцех, SnCl2 сильный восстановитель, он окисляется воздухом. Для сравнения - гидразин уж насколько сильный восстановитель, а его растворы воздухом не окисляются. Да, я тоже как-то так подумал о реакции вроде N2H4+4[H]->N2+4H2.
-
Уротропин из "сухого топлива" лучший вариант т.к. он доступен и его много. По эффективности ингибиторы растворения металла не сильно отличается друг от друга - любое средство для снятия ржавчины (хоть покупное, хоть самодельное), с любым количеством ингибитора, при нагревании довольно быстро разъедает железо. ПАВ не сильно помогают для снятия коррозии или грязи с железа. Самый лучший и самый простой вариант это лаурилсульфат натрия, который является главным моющим компонентом в любых жидких моющих средствах (жидкости для мытья посуды, гелях для душа, шампунях, жидкости для мытья пола и т.п. - всё это на самом деле очень близкие по составу смеси). К готовому составу с кислотой и уротропином добавить примерно четверть неразбавленного жидкого моющего средства, в кислой среде лаурилсульфат натрия пенности и моющих свойств не теряет. Сомневаюсь т.к. нитритная соль это почти чистая поваренная соль, а NaCl будет лишь способствовать коррозии. Также сомневаюсь что нитрит в разбавленном растворе всерьез защитит железо от коррозии. С нитритом натрия действительно есть составы для создания черных оксидных пленок на железе, но он там не главный компонент, основной компонент - NaOH, к которому (в зависимости от конкретного состава) в разных пропорциях добавлены нитрит натрия и нитрат натрия, но эта смесь работает не в разбавленном растворе, а выше 100 оС, в очень концентрированном растворе или в расплаве. Нет, у них у всех будут свои составы. Медь, бронза и латунь будут хорошо чиститься растворами содержащими аммиак (более мягкая альтернатива - смесь растворов аммиачной селитры и кальцинированной соды), а алюминий можно только заново отполировать т.к. он не корродирует, но сильно царапается. Также многое зависит от конкретного предмета и задачи - если речь идёт о чистке очень сильно прокородировавшей, но ценной медной монеты, может будет нерационально растворять продукты реакции меди с окружающей средой, а лучше будет использовать гидразин, который восстановит продукты коррозии обратно в металл. Иногда была цель почистить железо, по моему опыту, для этого нету ничего лучше, чем раствор трилона Б. Главное его преимущество - нейтральная рН среды, поэтому раствор трилона Б растворяет только ржавчину, но не металл под ней - можно надолго замочить изделие в растворе и забыть, или долго кипятить предмет в нём. После удаления ржавчины нужно взять тряпку или губку, тщательно вычистить с моющим средством (или с чистящим порошком) изделие от сажи, быстро (желательно до получаса) высушить и протереть минеральным маслом или оксоль-олифой. После этого у предмета будет более-менее приличный вид, он будет равномерным, серо-черным, без коричневых пятен и не будет корродировать на воздухе. Но, т.к. поверхность была изъедена коррозией, блестеть она не будет без полировки, какое бы средство не использовалось. Поэтому иногда проще почистить железяку наждачкой.
-
Труден, т.к. выход будет ничтожным. Даже карбамид+гипохлорит куда проще.
-
Оксиды многовалентных металлов наверняка будут разлагать - MnO2, PbO2 и т.п. Однако, откуда смесь хлора с его закисью и почему хлор нужно очистить от неё? Во-первых, обычно стоит обратная задача, во-вторых, в присутствии воды Cl2O это то-же самое что и HClO, а последняя образуется в т.ч. и при гидролизе хлора т.е. разница весьма условна.
-
С методической точки зрения это невозможная ситуация; разве что группы будут в несколько человек и предмет ну очень простым. Поскольку волновые свойства электрона выражены явно, то рассматривать электрон как шарик нельзя заранее. Вероятность нахождения электрона в некоторой точке пространства никак не противоречит тому, что полностью находиться в этой точке он не может по принципу неопределенности Гайзенберга. Если бы электрон находился бесконечно точно в определенных координатах, то имел бы бесконечно большой импульс; в реальности электрон "размазан" по пространству, просто в разных точках, вероятность обнаружить его разная. Почему именно так происходит можно без особого труда обосновать математически (да и просто рассуждая; на самом деле, принцип неопределенности можно вывести умозрительно, не используя не единого символа или числа), но истинные причины таких свойств у объектов микромира пока неизвестны. Однако, то что непонятны фундаментальные причины свойств, вовсе не означает что неизвестны сами свойства, именно обсуждаемые свойства электрона изучены и объяснены давным давно, эти объяснения связаны с математикой, отсюда и рекомендации от участников форума изучить их, используя математический аппарат.
-
Это преувеличение. Если в воздухе есть стирол, то это невозможно не почувствовать, стирол вонючий, это не говоря уже что изделие из полистирола сначала бы потеряло свою форму, а лишь потом начало бы разлагаться на мономер.
-
1 Нет. Если железо на аноде (подключен +) и электролит хлорид натрия, то оно будет растворяться и будет образовываться грязно-зеленая смесь гидроксидов двух и трехвалентного железа. Если на катоде, то на нем будет выделяться водород. Черный, липнущий осадок при растворении железа это сажа, она остается при растворении чугуна или металла инструмента, который был подвергнут науглероживанию (цементации), там получается очень явная граница - черная там где науглерожено и светлый металл где нет. 2 Счистить щеткой/ тряпкой с ПАВ - мылом или жидким моющим средством.
-
Это оксидная пленка удалилась с поверхности, плюс следы электролита, способствующие коррозии. Надо железяку хорошо вымыть, высушить, и протереть маслом.
-
Нет, это глупость. Чтобы происходил электролиз обычно достаточно очень небольшого напряжения порядка нескольких вольт, но скорость электролиза зависит от силы тока, а та через закон Ома от напряжения. Поэтому напряжение на ячейке регулируется из соображений получить нужную силу тока, оно всегда выше минимального.
-
В большинстве случаев примеси в электролите убивают кислотный аккумулятор. Если они могут окисляться и восстанавливаться, то приводят к быстрому разряду. Органика окисляется на аноде т.к. PbO2 сильный окислитель, хлориды, нитраты и т.п. минеральные ионы вызовут разрушение анода. Вроде, сульфат магния применялся в каком-то рецепте для восстановления аккумулятора, кроме того, для снятия сульфатации предлагалась смесь каких-то полифенолов (уже не помню о чём конкретно шла речь).
-
Если нужна концентрация как в книжке, то на 1 объем электролита надо добавить 2.5 объема дистиллированной воды, будет примерно 12% серная кислота (р=1.08). Но вообще, электролит не нужно разбавлять как таковой, он уже разбавлен до нужной концентрации. Концентрация кислоты связана с циклом разрядки/зарядки аккумулятора, если электролит не выливался из аккумулятора, то доливать новую серную кислоту в него не нужно т.к. сульфат-анион никуда из аккумулятора не делся. При зарядке аккумулятора концентрация кислоты повысится до нужной сама по себе. Напряжение на клеммах аккумулятора ни о чем не говорит. Если взять убитый аккумулятор и залить в него свежий электролит, то напряжение повысится почти до нормального и аккумулятор даже будет немного заряжаться с повышением напряжения (13.5В как минимум для 6 ячеек). Это происходит потому что ЭДС ячейки зависит от концентрации серной кислоты. Однако, ёмкость (т.е. сколько А*час может выдать аккумулятор) какой была ничтожной, такой и останется, аккумулятор будет очень быстро разряжаться, запитать с него можно будет разве что несколько светодиодов. Для зарядки аккумулятора подходит любое зарядное устройство, выдающее напряжение минимум 14-15В постоянного тока. Кислотные аккумуляторы, вообще говоря, можно заряжать даже сетевыми 230В, выпрямленными через диод или диодный мостик, главное ограничение силы тока (в случае 230В оно достигается подключением последовательно лампочки накаливания). Вроде даже считается что большие напряжения (или большие значения силы тока) полезны для снятия сульфатации, но на практике, сульфатацию так просто не снять. Проще сдать умерший аккумулятор и купить новый. Анод там еще интереснее, он состоит из смеси оксидов свинца, при прокаливании можно PbO получить, а при обработке щелочью ярко-красный свинцовый сурик получается.
-
Увы, углерод максимум четырехвалентный.
-
Там проблема скорее в том что нужно очень много хлора и его трудно полностью использовать. Именно по ароматическим карбоновым кислотам трудно сказать, но вроде ацетат алюминия, либо безводная смесь ацетата натрия с сульфатом алюминия, при сухой перегонке дают уксусный ангидрид. Для других карбоновых кислот должны быть соли, разлагающиеся с выделением ангидридов. Теоретически, можно попробовать заменить сульфат алюминия на хлорид, может будет хлорангидрид, хотя при наличии ароматического ядра, в присутствии алюминия, наверняка пойдет реакция Фриделя-Крафтса.
-
По-моему, главные свойства CCl4 это его инертность к хлорирующим агентам, его растворяющая способность и низкая температура кипения. Он растворяет NCl3, давно хотел попробовать как такой раствор будет взаимодействовать со склонной к реакциям присоединения органикой. NH2Cl тоже интересно, по идее, он может растворяться в CCl4.
-
Можно взять избыток диметилсульфоксида, а серы гораздо меньше чем нужно по уравнению; продукты реакции можно разделить перегонкой.
-
Электростатические силы слабы относительно других взаимодействий в атомах. Вероятно, сильное взаимодействие, и получило своё имя поэтому. Просто есть физика макромира, базирующаяся на теории относительности, а есть квантовая теория, несовместимая с теорией относительности, но хорошо описывающая микромир, которая и используется в химии. Хе, а с моей точки зрения пространство теории относительности, которое просто существует и по которому просто распространяются электромагнитные волны, наивно и неадекватно. Учёные давно над этим бьются, но из всевозможных теорий всего пока можно сделать можно лишь два противоположных предположения: 1 Либо мироздание чрезвычайно сложно для нашего восприятия и мы имеем дело с очень сложным и многомерным мирозданием (как минимум около десятка или больше измерений). 2 Либо мироздание в реальности более простое, но мы (в силу самого человеческого, бытового, мышления) что-то упускаем.
-
Это просто рисунок; можно считать что находиться электрон в ядре практически не может, вероятность обнаружить его там ничтожна. Скорее, было наоборот - сначала в результате большого числа физических и химических наблюдений пришли к выводу что существует электрон, его заряд оказался -1, соответственно у ядра заряд положительный. Обычно используется выражение вроде "падение электрона на ядро". Тут нужно помнить, что электрон не является шариком, вращающимся вокруг ядра и имеющим точное положение в пространстве. Вместо этого, в квантовой теории используется вероятность обнаружения электрона в той или иной части пространства. Вероятность обнаружить электрон в ядре очень мала, само ядро имеет чрезвычайно высокую плотность и мало по сравнению с условными размерами атома и теми областями пространства, в которых вероятность обнаружить электрон высока. Электростатического взаимодействия ядра и электрона/ов недостаточно, чтобы повлиять на вероятность нахождения электрона настолько, чтобы он оказался в ядре. Тем не менее, в случае радиоактивного распада атомов, есть определенная вероятность что электрон из ближнего к ядру уровня будет им захвачен; это явление называется электронным захватом - протон ядра захватывает электрон атома, превращаясь в нейтрон и нейтрино, образуется новое ядро и новый элемент. Именно потому что используются вероятностные характеристики, некорректно утверждать что электрон пребывал в ядре или не пребывал там.
-
Это сложная техническая задача т.к. гибкими в основном являются металлы или органические полимеры, вторые имеют низкую электропроводность, их механические свойства являются приемлемыми лишь в узком интервале температур. Среди сплавов есть такие которые становятся более пластичными при охлаждении, хотя речь идет о достаточно сильном охлаждении (например жидким азотом), вроде никонель к таким относится. Т.е. можно сделать нужную деталь, поместить ее в охлаждающую среду и для уменьшения пластичности греть током, поскольку пластичность в данном случае будет зависеть от температуры, то путем регулирования температуры, можно регулировать и пластичность. Второй вариант не столько химический - можно попытаться использовать обратный пьезо-эффект. Если вещество (там скорее будет не индивидуальное вещество, а какой-то материал) известно, например, из патентов, то синтезировать его будет относительно просто.