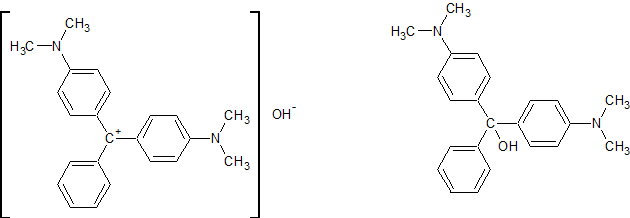-
Постов
34957 -
Зарегистрирован
-
Победитель дней
1166
Весь контент yatcheh
-
Ну, боросиликатное стекло отличается ещё и химической стойкостью. К тому же я не говорил, что их НЕЛЬЗЯ нагревать (хотя пластиковые приблуды несомненно расплавятся), я говорил, что мерная посуда не предназначена для этого. Потом, вряд ли на заводе стеклопосудном будут кроить, и мерную посуду делать из обычного стекла. Это просто не технологично. Всю линейку посуды варят из одного сорта стекла, если к посуде нет каких-то специальных требований.
-
Оранжевое? Походу тут краситель поменял ориентацию... При окислении азотной кислотой синий индиго переходит в оранжевый изатин. К сожалению - необратимо.
-
Мерные колбы не для нагрева. Пластик расплавится. Нагревать можно хоть до размягчения, дело-то не в температуре, а в температурном напоре. Для пирекса, к примеру, это 90С. Т.е. посуда гарантированно выдерживает разность температур внутренней и внешней поверхности стенки в 90С. Может и больше, но уже без гарантии производителя.
-
Она, родимая. Я как-то на пальто плеснул азоткой. Смыть-смыл, нейтрализовал, дырки не получилось, но шерсть окрасилась. При чём на солнышке особенно хорошо было видно (флуоресценция?) неприличное жёлтое пятно. Я его попытался вывести двуххлористым оловом. Пятно поменяло цвет на светло-серый и перестало флуоресцировать.
-
От концентрации зависит. Чем больше глицерина - тем сильнее. В крепком раствре pKa ниже 4 опускается.
-
1 и 2 правильно, а дальше - гнутие ствола. 3. Замещается хлор при карбониле получается амид. Ароматический хлор инертен. 4. Реакция Гофмана, получается 4-хлоранилин 5. ацилирование анилина по азоту. Полдучаеццо N-(4-хлорфенил)бензамид
- 1 ответ
-
- 1
-

-
Двухэлектронное окисление формаля: CH2O + -ОOH => -O-CH2-OOH => H2 + HCO3- Ну, или так: CH2O - 2e + 4OH-= CO3(2-) + H2 + 2H2O H2O2 + 2e = 2OH- Хотя, это, конечно, ещё не механизм, но если покрутить дули - можно нарисовать подробнее Есть такой принцип (не помню автора) - система переходит не в самое устойчивое состояние, а состояние, самое близкое по устойчивости, т.е. скачет по локальным минимумам. И вот, в процессе окисления формаля у углерода возникает возможность перейти, накоенц - в карбонат. Ценой отщепления водорода. Он это и делает, переходя в ближайший локальный минимум. А молекулярный водород уже не окисляется перекисью, и благополучно смывается из зоны реакции.
-
Для глицерина и борной кислоты никакие катализаторы не нужны. Фосфорная кислота - это фосфор. Аммиак - это азот. Бор - микроэлемент. Уксусная кислота - регулятор кислотности, шоб фосфора не валить лишку, и pH аммиаком не задрать. Глицерин - ноу-хау изобретателя. Нужен он там, не нужен - бог весть. Но выглядит солидно. Можно ценник хороший выкатить - за патент И производителю выгодно, и потребителю приятно быть на фронтире науки
-
Если уксусной кислоты кислоты достаточно, и если греть до упора, то можно получить триацетин. С аммиаком при н.у. будет очень-очень медленная реакция аммонолиза сложного эфира.
-
При -137С мало что мало в чём растворяется. Тут уже не все жидкие газы смешиваются, а вы про растворение твёрдых веществ.
-
Приёмник вешать на систему не надо. Просто подставить под кран. А всю остальное крепить в двух точках - за колбу плотно зажатой лапкой, но с возможностью поворота её (лапки) по оси. Вторая точка - за верх холодильника, только не подвесом, а упором, с люфтом. Без приёмника вес будет небольшой, не сломается.
- 4 ответа
-
- 1
-

-
Лучше купить второй холодильник, и подключить его как нисходящий к верху обратного. Просто перекрывать воду. Вода в обратном течёт - экстракция, перекрыл воду - перегонка.
- 4 ответа
-
- 1
-

-
Не растворится он в значительном количестве. Будет лежать на дне осадком. Вот если эту смесь охлаждать (от н.у. - чтобы СО2 успел прореагировать с метанолом), то наверное можно получить метилугольную кислоту в твёрдом виде.
-
Электрофильное замещение в бензоле облегчают донорные заместители. Учитывается мезомерный и индуктивный эффекты. нитробензол < бензолсульфокислота < бензойная кислота < бромбензол < толуол < фенол
-
Падение теплоты плавления - это не важно. Важны только теплота плавления при 0, теплота смешения и интеграл по теплоёмкости от 0 до -100 (к примеру). Это относится не к температуре плавления эвтектики, как таковой, а именно к самопроизвольному охлаждению при плавлении эвтектики. А если всё предварительно охлаждать - чё тут интересного? Ну, смешаешь килограмм твёрдого метанола (-100С) с кусочком льда (0С). Ну, получится -137С - аж на сорок градусов ниже исходной температуры! Очешуеть - какое достижение!
-
Хлор сильно активирован двумя нитро-группами в орто- и пара-положениях, поэтому легко вступает в реакции нуклеофильного замещения. В этом смысле 2,4-динитрохлорбензол ведёт себя подобно хлорангидридам кислот. Получается (NO2)2C6H3-Cl + NH2-C4H9 -(K2CO3, -KCl, -KHCO3)-> (NO2)2C6H3-NH-C4H9 (N-бутил-2,4-динитроанилин)
- 2 ответа
-
- 1
-

-
Строго говоря, нитросоедиение щелочного плавления не переживёт. Поэтому надо сначала восстановить нитрогруппы, а уж потом плавить.
- 3 ответа
-
- 1
-

-
Здесь сама реакция неверная. Таких можно много накидать, более явных. К примеру H2O + NaCl = NaH + HOCl
-
Приведённое название отвечает одной из крайних мезоформ диссоциированного вещества. Обычное название (как для трифенилметанового красителя) будет бис-[4-(диметиламино)фенил]-фенилметанол. Как пишут - да, основание малахитового зелёного Ж.