-
Постов
2427 -
Зарегистрирован
-
Посещение
-
Победитель дней
17
Весь контент pauk
-
dmr, вы чересчур много нафантазировали. 1. Квасцы являются двойными солями, ибо структуру комплекса они принимают только будучи в кристаллическом виде, а при растворении в воде полностью распадаются на составляющие их катионы металлов и сульфат-ионы. Поэтому они не смогут связать в комплексы имеющиеся в растворе сульфат-ионы. 2. Натрий образует квасцы только с алюминием и хромом, и больше ни с какими другими сульфатами трёхвалентных металлов, включая железо. Но эта ценная информация уже не пригодится (см. пункт 1). 3. Варианты с добавлением кислот даже не заслуживают рассмотрения. Неэффективно, неэкономично, неэкологично. 4. С полным обессоливанием раствора добавлением фторида серебра тоже всё понятно, это химический юмор. Но если посмотреть чисто с научной точки зрения, то этот метод обессоливания никуда не годится. Всё кучей в осадок не выпадет, ибо растворимость NaF в воде равна 4%, а Ag2SO4 - 0,8%. 5. Выбить сульфаты в осадок хлоридом свинца из натрий-хлоридного раствора не удастся. Наоборот, в гидрометаллургии свинца применяют метод перевода сульфата свинца в раствор при обработке его крепким раствором хлорида натрия, в котором он хорошо растворим благодаря образованию комплекса: PbSO4 + 4NaCl ==> Na2[PbCl4] + Na2SO4
-
Можно обменной реакцией 2CsI + PbCl2↓ (белый) ==> 2CsCl + PbI2↓ (жёлтый) Малорастворимый хлорид свинца переходит в ещё менее растворимый иодид свинца. Если взять вещества строго по стехиометрии, то больше ничего и делать не надо. Но на практике достичь этого вряд ли удастся, поэтому отфильтрованный от осадка PbI2 раствор CsCl надо освободить от остаточного PbCl2, обработав его небольшим количеством сероводородной воды: PbCl2 (р-р) + H2S ==> PbS↓ (чёрный) + 2HCl
-
Lyussy, чтобы не мучаться, я сделал выборку страниц из справочника, на который ссылается dmr (Здановский А. Б. и др. Справочник экспериментальных данных по растворимости многокомпонентных водно-солевых систем, том 1, 1953, стр. 58-86): NaCl-Na2SO4-H2O.djvu Здесь собраны в кучу десятки таблиц хороших и разных по системе NaCl - Na2SO4 - H2O от разных авторов за разное время. В конце есть даже диаграмма совместной растворимости. Желаю успехов в решении вашей неподъёмной задачи!
-
Полистал некоторые книжки, и вот что вкратце впитал по теме. Для тория единственной встречающейся в растворах степенью окисления является +4. Соединения тория +2 и +3 немногочисленны и в большинстве своём неустойчивы к воздуху и влаге, поэтому не могут быть получены из растворов, хотя известно исключение, о котором пишут Гринвуд и Эрншо в своей "Химии элементов". При смешивании растворов ThCl4 и HN3 был получен раствор янтарного цвета, содержащий гидратированные ионы Th3+, которые просуществовали в растворе более часа, прежде чем были полностью окислены водой. Соли с оксокатионом МеО2+, подобные титанилу и цирконилу, для тория нехарактерны. При кристаллизации из подкисленных растворов большинство солей тория выделяется с простым катионом Th4+. Такой же катион входит и в состав малорастворимых солей тория, осаждаемых из раствора. В качестве исключения можно указать малорастворимый оксокарбонат ThOCO3*8H2O, осаждаемый из растворов солей Th4+ карбонатами ЩМ. Если же среда раствора недостаточно кислая, то соли тория начинают гидролизоваться, причём существует мнение, что при этом образуются не оксосоли с катионом типа МеО2+, а гидроксокомплексы типа Th(OH)22+ или Th(OH)3+. Оксосоли ThOF2, ThOCl2, ThOSO4 и т. п. получают при термическом разложении соответствующих солей с катионом Th4+. В общем, можете скачать отсюда книжку Каплан Г. Е. с соавторами "Торий, его сырьевые ресурсы, химия и технология" и просвещаться.
-
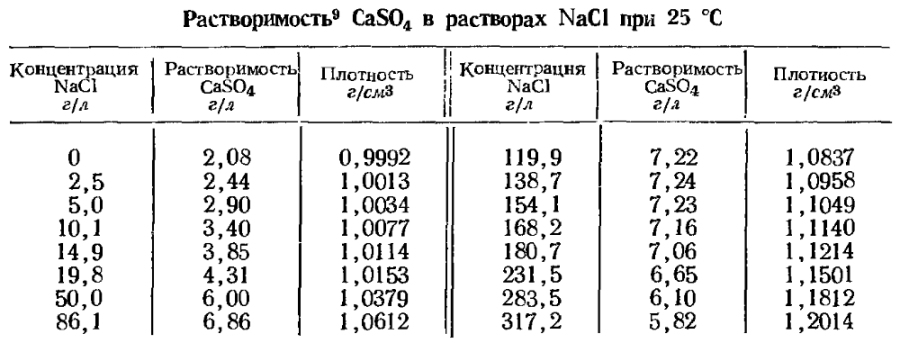
Думается, что достичь остаточной концентрации сульфатов 0,01% в хлоридно-сульфатных растворах выпариванием или добавлением хлорида кальция не удастся. Для справки я приведу табличку растворимости сульфата кальция в растворах хлорида натрия. Помочь горю мог бы BaCl2 в стехиометрическом количестве: Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl. Но растворимые соли бария токсичны, да и недёшевы. Кроме того, в полный рост встаёт вопрос, куда девать балластный BaSO4? Так что в промышленном масштабе эта затея нерентабельна.
-
Есть ли возможность ввести в бета-версию поиска хоть какие-то опции сортировки результатов (по дате, по авторам, по разделам форума и т. п.). А то с этим делом форменный бардак.
-
Читаем весь топик вдумчиво, не торопясь. Желтоватый окрас появился и при прокаливании оксида магния, и при холостом опыте (без прокаливания) с серной кислотой и молибденовым реактивом по ГОСТ 31753.
-
Изменение окраски из белой в желтоватую при нагревании могут давать примеси нерастворимых солей свинца и кадмия (например, карбонатов), которые при прокаливании переходят в оксиды PbO и CdO, окрашенные в цвета от жёлтого до красного в зависимости от размера частиц и кристаллической модификации. А жёлтую окраску с молибденовой жидкостью помимо фосфат-ионов дают также соли мышьяковой кислоты H3AsO4. Если вы не упали в обморок от прочитанного, то можете для начала сделать качественный анализ образца на присутствие тяжёлых металлов. Растворить небольшую порцию исходного оксида магния в азотной или уксусной кислоте без большого избытка, а потом прилить к раствору сероводородной воды либо сульфида ЩМ или аммония. Если в растворе есть ионы тяжёлых металлов, то выпадет осадок их сульфидов - ярко-жёлтые CdS или As2S5, белый ZnS, чёрный PbS.
-
А вы не охлаждали оксид магния после прокаливания? Например, оксид цинка ZnO при нагревании до температуры выше 250°С обратимо меняет окраску с белой на жёлтую. Для восстановления первоначальной окраски требуется некоторое время.
-
Фосфаты дают жёлтую окраску с молибденовой жидкостью с незапамятных времён. Так что всё она делала правильно, только назвала серную кислоту чёрной, потому что клавиши Ч и С на клавиатуре расположены рядом, и она промазала от волнения. Аналитическая реакция на фосфат-ионы с молибденовой жидкостью: PO43- + 3NH4+ + 12MoO42- + 24H+ = (NH4)3[P(Mo3O10)4]↓ (жёлтый) + 12H2O В оксиде магния есть что-то постороннее, надо найти объяснение, почему он окрашивается в жёлтый цвет при прокаливании.
-
Шизума помногу и без остановки кропает собщения на любые темы буквально во все разделы форума. Выше по теме я уже обращал на это внимание. У меня складывается впечатление, что за ширмой Шизумы скрывается целый коллектив авторов, типа Кукрыниксов.
-
Ртуть запретили из-за япошек, которые вместо того, чтобы пахать и сеять, питаются морепродуктами, вот и траванулись. Прощай ртуть Болезнь Минамата Минаматская конвенция о ртути
-
По фото не поймёшь, а по надписи над ней понять можно. "Мама в моём детстве". Галинстановые термометры появились совсем недавно, а St2Ra3nn8ik явно не вчера вышел из детского возраста. Так что гидраргирум однозначно.
-
Координационная связь - содержанка.
-
Есть. Любая щёлочь. После отгонки спирта уксусная кислота выделяется непрекурсорным раствором серной кислоты.
-
Радиохимия наверное. Говорят будто бы в Чернобыльской зоне растут грибы по колено.
-
Вчера Песков сказал, что Минобороны отправилось к ближайшему орешнику за новою метлой.
-
Можно сфоткаться в противогазе с колбой, на которой крупными буквами написано VX.
-
Галлий действует на металлы значительно агрессивнее ртути. Многократно обхаянные Рипан и Четяну пишут, что единственные металлы, на которые не действует галлий, - это тантал (до 450°С) и вольфрам (до 800°С).
-
У группы -NO2 чёрточка посередине строки, а у аниона NO2- вверху. Эта чёртова чёрточка не даст осуществиться вашей мечте.
-
V(CO2) = 22,4*4,8*1020/NA = ... NA = 6,022*1023 (число Авогадро) n(H2) = 56000/M(H2) = ... M(H2) = 2 (молярная масса водорода) V(H2) = n(H2)*22,4 = ... N(H2) = n(H2)*NA = ...
-
А, так ты зрячий!