-
Постов
2427 -
Зарегистрирован
-
Посещение
-
Победитель дней
17
Весь контент pauk
-
В задании говорится о четырёх соединениях, а именно, о двух изомерных карбоновых кислотах и двух изомерных продуктах их декарбоксилирования.
-
И, соответственно, масляная и изомасляная кислоты после декарбоксилирования
-
Красота понятие эфемерное: сегодня она есть, а завтра - проехал трамвай, и её нету (почти по Булгакову). И вообще, в женщине важна не внешняя красота, а функционал. После свадьбы рыбака друзья спрашивают его: Когда ты женился, то разве не видел, что невеста кривая, хромая и горбатая? Видел, конечно... Так зачем же ты на ней женился?! О, если бы вы знали, какие чебачки на её глистов клюют!
-
Вы бы написали, что за вещество собираетесь получить, тогда было бы яснее, о каком сырье идёт речь. Я полагаю, что речь всё же идёт не о печном топливе, на которое ссылаются коллеги, а именно о печном масле. Печное топливо - смесь из низкосортных или некондиционных нефтепродуктов (дизтоплива, отработанных масел, мазута и т. п.), предназначенная для сжигания в топках печей или котлов с целью получения тепловой энергии. Очевидно, что из печного топлива ничего путного получить не удастся. Печное масло - продукт каталитического дегидрирования этилбензола в стирол (а также изопропилбензола в α-метилстирол) в технологии мономеров для СК и пластмасс. Думается, что это название несколько устарело. Дело в том, что в ранних технологических схемах использовался реактор трубчатого типа (трубчатая печь) с внешним обогревом поверхности трубок топочными газами от сгорания топлива. Впоследствии эта схема стала вытесняться более экономичной схемой с адиабатическим реактором, в котором нет поверхностей теплообмена, так как тепло подводится за счёт подачи перегретого водяного пара непосредственно в зону реакции. Называть этот агрегат печью как-то не с руки. Тем не менее традиционное название "печное масло" сохранилось. Печное масло идёт далее на ректификацию для выделения стирола (целевой продукт). Остаточный этилбензол возвращается в начало процесса. Примерный состав печного масла: стирол - 54%; этилбензол - 41,8%; бензол - 2%; толуол - 2%; смола - 0,2%. В продукте присутствуют также следы дивинилбензола, α-метилстирола и др. Во избежание полимеризации стирола в печное масло добавляют ингибитор (гидрохинон). PS. Возможно, что это название применяется ещё для каких-либо пирогенетических продуктов, получаемых в процессах переработки нефти, но то мне не ведомо...
-
Возьмите равные количества по массе.
- 3 ответа
-
- 1
-

-
Ну, на метр я и на Земле подскочить смогу, если с разбегу. Стоит ли ради этого лететь на Марс.
-
Масса Марса почти в 10 раз меньше земной. Если я на Земле могу подпрыгнуть на полметра, то на Марсе на 5 метров? А если туда скакуны с незалежной прилетят? Кошмар!
-
При реакции с цинком в кислой среде получится молибденовая синь Способы получения металлического молибдена (Р. Рипан, И. Четяну - Неорганическая химия, том 2, 1972):
- 2 ответа
-
- 1
-

-
Задание 1 (расчётный метод). Масса р.в. в исходном растворе: 100 ----- 12 80 ------ ?? ?? = 80*12/100 = 9,6 г х - искомая масса добавляемого р.в. Общая масса р.в. в растворе после добавления р.в.: 9,6 + х Масса раствора после добавления р.в.: 80 + х Пропорция для вычисления х: 100 --------- 20 (80 + х) ---- (9,6 + х) (80 + х)20 = (9,6 + х)100 ==> 80 + х = 48 + 5х ==> 4х = 32 ==> х = 8 г Таким образом, для получения 20% раствора р.в. к 80 г 12% раствора р.в. необходимо добавить 8 граммов р.в.
-
У меня возникли сомнения с правописанием. Посмотрел как растолмачивают это слово в толковых словарях. Конченый (прилагательное), т. е. полностью завершённый. Но живой. Конченный (страдательное причастие). Это уже не живой.
-
В вики пишут, что у него есть дочь Светлана Вячеславовна. В той же статье приведён список имущества, которым владела или владеет его мама, которой сейчас под 90 лет, и которая всю жизнь проработала учителем в сельской школе. По сравнению с мамой Славик нищий голодранец.
-
В вашем задании ошибка. Исходный углеводород с формулой C6H12 может быть либо алкеном, либо циклоалканом. Но ни алкены, ни циклоалканы не восстанавливаются натрием в спирте. Совсем другое дело, если исходный углеводород имеет формулу C6H10 и содержит одну тройную связь, которая восстанавливается натрием в спирте до двойной. Тогда всё складывается: CH3-C☰C-CH(CH3)2 --[H]--> CH3-CH=CH-CH(CH3)2 --[O]--> CH3-COOH + (CH3)2CH-COOH Исходный углеводород - 4-метилпентин-2, или 4-метилпент-2-ин по продвинутой номенклатуре.
-
Был я однажды на военных сборах в Елани. В целях безопасности все берёзовые рощи вокруг полигонов были объявлены заказниками, чтобы не шлялись грибники, туристы и прочие посторонние. Так вот, у дороги, ведущей в одну такую рощу было табло с надписью: "На территории заказника категорически запрещается разводить костры и особенно оставлять их непогашенными!" (Не анекдот)
-
Если эту энергию поделить на четыре авогадры, то получается, что 1 атом бора сгорает, выделяя ~ 1,9*10-18 Дж.
-
Unogasay, у вас симптомы невротической прокрастинации (пункт 3).
-
Некогда молиться! Ибо страшнее баб катаклизма нет! Посмотри, что они вытворяют с нашим братом. Так что приходится постоянно быть начеку.
-
Неужели в таких задачах по органике нынче требуют уравнивать реакции окисления? В наши древние времена достаточно было написать её без коэффициентов, а то и вовсе в виде схемы со стрелками типа C2H5–CH=CH–C2H5 (t, KMnO4, H2SO4)--> C2H5COOH 5C6H12 + 8KMnO4 + 12H2SO4 = 10C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O Этого хватит, или нужны полуреакции?
-
Можно, конечно, налить в колбу с эфиром раствор щёлочи, заткнуть её пальцем и ждать, пока всё устаканится. Но лучше всё же греть колбу до кипения РМ. Старик Вант-Гофф не даст соврать.
-
Мне легче отодрать от кубика Рубика все цветные накладки, а потом заново наклеить их в нужном порядке, чем собирать его.
-
Что именно, крест или голимую математику?
-
Лёд, вода и пар с точки зрения непосвящённого - это три разные сущности. Для первого случая они на тюбике писали бы "морозостойкий" или "морозоустойчивый", а для последнего - "паростойкий". Кстати, есть и такой термин. Я смотрел в интернете, есть даже такой нормируемый параметр: "паростойкость клеевого шва" (только там было не про дерево, но какая, в принципе, разница)
-
Да? А чего же тогда при катастрофических наводнениях и извержениях вулканов все бегут и орут, а не хрустят попкорном, спокойно взирая на катаклизм?
-
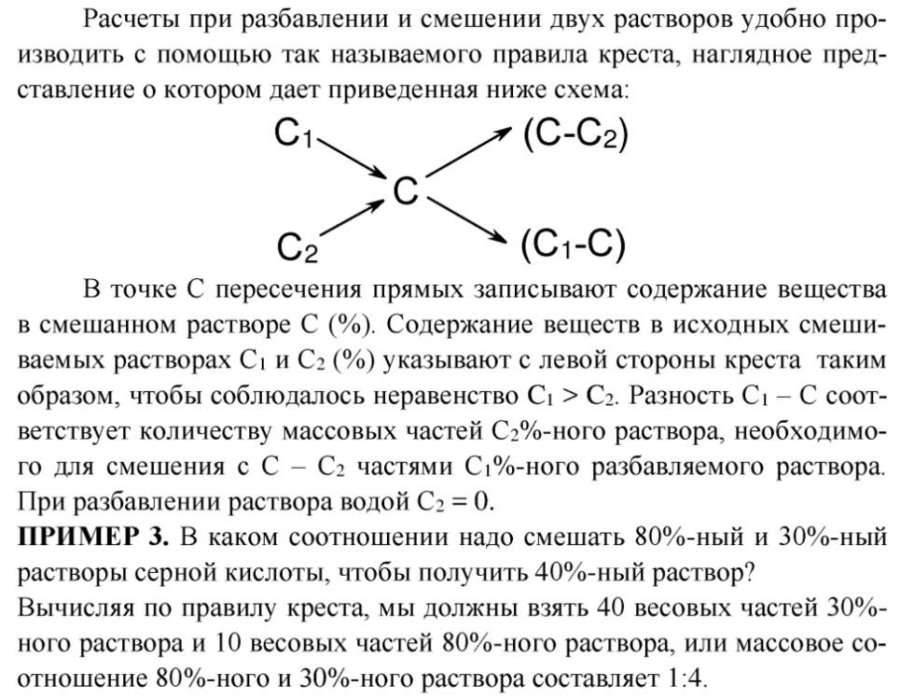
Задания быстро решаются с помощью т. н. "правила креста". Только надо помнить, что при использования этого правила все значения должны выражаться в единицах массы, а не объёма. Поэтому в задании 2) надо предварительно пересчитать объём раствора на его массу: m = pV. Если такой вариант не устраивает, то решайте задания стандартным методом через нахождение масс растворённого вещества в исходных, добавляемых и конечных растворах, составление пропорций и т. д.