-
Постов
2427 -
Зарегистрирован
-
Посещение
-
Победитель дней
17
Весь контент pauk
-
а) 4KOH + TiCl4--> 4KCl + Ti(OH)4, или H4TiO4 (ортотитановая кислота). Выпавший осадок при стоянии обезвоживается и, теряя молекулу воды, постепенно переходит в TiO(OH)2, или H2TiO3 (метатитановая кислота). б) При обычной температуре: 2KOH + Cl2 --> KClO + KCl + H2O. При температуре от 70°С и выше: 6KOH + 3Cl2 --> KClO3 + 5KCl + 3H2O
-
Зачмырив ЛГБТшников, Трамп рискует ничего не успеть сделать. Второй раз пид@расы уже не промахнутся.
- 96 ответов
-
- 1
-

-
- скайнет
- цифровой концлагерь
-
(и ещё 3 )
C тегом:
-
Так за чем дело стало? Квадриллионер.
- 96 ответов
-
- скайнет
- цифровой концлагерь
-
(и ещё 3 )
C тегом:
-
Тут палка о двух концах. Вполне вероятно, что как только вы выйдете на пенсию, администрация тут же начнёт выдавливать вас с предприятия под разными предлогами, ибо ей спокойнее поставить на ваше место нового человека, пусть даже с меньшим опытом, чем ждать, что у вас не дай бог вылезет какое-нибудь профзаболевание. Сам по себе I список никаких материальных преференций не приносит, за исключением права на досрочное оформление пенсии, которая, как правило, весьма средняя из-за короткого трудового стажа. Так что в большинстве случаев придётся подыскивать новую работу или подаваться на вольные хлеба в индивидуалы, ибо с таким послужным списком хорошую работу вам вряд ли предложат...
-
Всё проще гораздо. Он его в гранёном стакане делал на 250 гр. Если бы налил уксусу больше, то пена попёрла бы через край.
- 41 ответ
-
- 2
-

-
Качество американского металла 100-летней давности хуже, чем советского 50-летней давности. Я свою советскую мясорубку сроду не протирал после мытья (кроме ножей).
-
Я ничего не решал, просто возникла пара замечаний по ходу. Если Н2 + Cl2 --> 2HCl (при освещении), то при постоянной температуре давление в сосуде не должно увеличиваться. Наряду с HCl + NaOH --> NaCl + Н2О (поглощение раствором щелочи) протекает реакция Cl2 + 2NaOH --> NaClO + NaCl + H2O
-
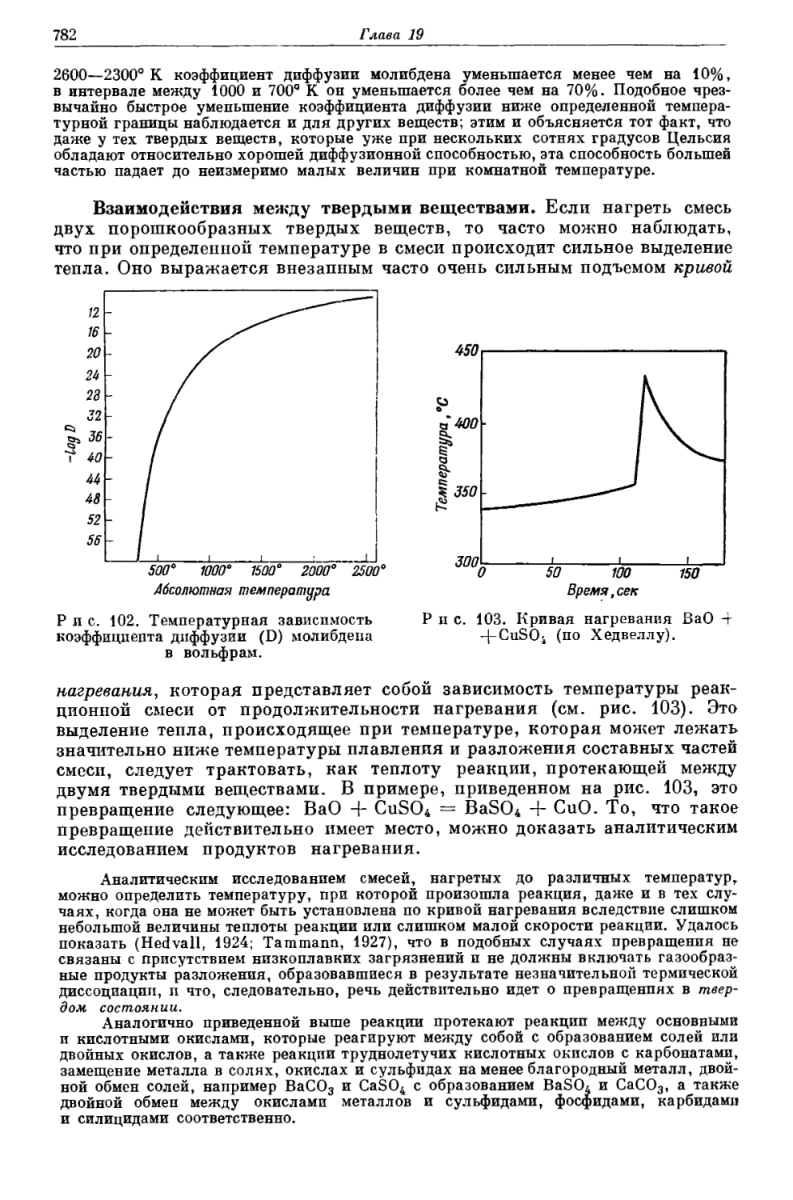
Ищущий да обрящет. Это из книги "Курс неорганической химии" (Реми Г., 1966). В конце второго тома есть глава 19 "Реакции твёрдых веществ". Вот страничка из неё: Таким образом, реакция между оксидом бария и сульфатом меди именно твёрдофазная, а не двухстадийная с промежуточным выделением серного ангидрида по схеме CuSO4 (t) --> CuO + SO3 и BaO + SO3 --> BaSO4
-
Мясо вредно.
-
Согласие Зеленского на переговоры никак не повлияет на СВО, которая будет продолжаться вплоть до заключения итогового соглашения, ибо Россия уже несколько раз наступала на эти грабли, и её интересует не трезвон в медийном пространстве, а выполнение конкретных условий, которые будут тяжёлыми для укропов.
-
Там тоже только I часть, а II и III нет...
-
После чего это утёкшее лишнее окисляется при контакте паров с воздухом.
-
Отсюда практическое правило - прежде чем взбзднуть, повернись лицом к ветру!
-
Чистая борная кислота не имеет запаха. Запах может субъективно ощущаться только, если мелкие частицы борной кислоты попадают на слизистую носа и раздражают её. Аптечная борная кислота состоит из довольно крупных частиц в виде чешуек и пахнуть не должна. Если это специальный препарат против насекомых, то кроме мелко размолотой борной кислоты, он может содержать разного рода мелкодисперсные наполнители и добавки, чтобы препарат лучше прилипал к телу насекомых. В любом случае, открыв балкон и создав сквозняки, вы поспособствовали подъёму пылинок борной кислоты в воздух. Аккуратно сметите щёткой порошок, протрите это место несколько раз влажной тряпкой и вымойте пол.
- 13 ответов
-
- 1
-

-
- сколько действует
- как можно смыть
- (и ещё 1 )
-
Примеров более чем достаточно: - образование шпинелей при прокаливании смесей соотвествующих тугоплавких оксидов - образование боридов, карбидов, силицидов тугоплавких металлов спеканием порошков - двойной обмен при нагревании смесей солей, например, BaSO4 + CaCO3 --> BaCO3 + CaSO4 - обменные реакции между разными классами соединений, например, BaO + CuSO4 --> BaSO4 + CuO - и т. д. О последней реакции где-то читал, что она начинается внезапным скачком температуры смеси при нагревании её до 350°С и столь же быстро заканчивается. Если это кому-то интересно, то могу поискать источник информации. По крайней мере, сам додуматься до этого я бы не смог
-
Хлор с относительной атомной массой 35,45 испокон веков округляют до 35,5. Только не говорите, что вы этого не знали. А здесь дробная часть ещё ближе к половине. Так что берите 85,5 и не парьтесь.
-
Железо могло поржаветь, если продукт был недостаточно очищен от следов HCl. Гидролиз с образованием HCl за счёт примеси воды в продукте или её паров в воздухе исключён, так как ни дихлорэтан, ни трихлорэтилен при обычных условиях не гидролизуются. Однако подобно хлороформу, трихлорэтилен способен самопроизвольно окисляться, особенно при действии света, с образованием хлористого водорода, угарного газа и фосгена: CHCl=CCl2 + O2 --> HCl + CO + COCl2 Что касается дегидрохлорирования трихлорэтилена, то железо тут не при чём, ибо в промышленности хлоруглеводороды транспортируют в стальных оцинкованных бочках. Но трихлорэтилену категорически противопоказан контакт со спиртовыми растворами щелочей или твёрдыми щелочами во избежание образования дихлорацетилена, который самовоспламеняется со взрывом при контакте с воздухом: CHCl=CCl2 + NaOH --> CCl☰CCl + NaCl + H2O Впрочем, вам все эти страсти не грозят, так как трихлорэтилен (если это был он) давно уже улетел.
-
1. Уравнивание ОВР методом электронно-ионного баланса: 1| S + 8OH- - 6e- = SO42- + 4H2O 3| Br2 + 2e- = 2Br- ------------------------------------------- S + 3Br2 + 8OH- = SO42- + 6Br- + 4H2O S + 3Br2 + 8KOH = K2SO4 + 6KBr + 4H2O 2. Почётное право определения молярных масс эквивалентов окислителя и восстановителя я уступаю вам. Молярная масса эквивалента или эквивалентная масса для реагента в окислительно-восстановительном процессе равна его молярной массе, поделенной на число электронов в соответствующей полуреакции Если самостоятельно не справитесь, то посмотрите примеры здесь
-
На уровне моря на каждого человека давит столб воздуха весом 15 тонн. В горах эта ноша легче, поэтому горцы меньше горбатятся.
-
Я думаю, что в разделе Вопрос-ответ целесообразнее по умолчанию установить сортировку сообщений по дате, а не по голосам, как сейчас. Дело не только и не столько в том, что оценки форумчан сугубо субъективны и не всегда совпадают с истинным положением вещей. Но когда читаешь ответы форумчан, рассортированные по рейтингу, то происходит полная неразбериха и разрыв шаблона, так как разрушается цельность темы и становится непонятно, кто о чём писал, в каком контексте и по какому поводу, особенно, если тема длинная. А если кто захочет посмотреть рейтинг сообщений, пусть переключает опцию.
-
Контрактного или контрафактного?
- 3 ответа
-
- 1
-

-
- покупка
- производство.
- (и ещё 3 )
-
Давай, меняй поскорее, пока не привлекли за незаконное использование бренда. DMR
-
Вычислите с необходимой вам точностью молярные массы хлорида аммония NH4Cl и иона аммония NH4+, после чего разделите первое значение на второе. Получите коэффициент для пересчёта, на который надо умножать заданные значения концентрации иона аммония и объёма раствора для приготовления его из NH4Cl. В общем виде расчётная формула имеет следующий вид: mNH4Cl = k*CNH4+*V mNH4Cl - навеска хлорида аммония, мг k - коэффициент, равный отношению молярных масс хлорида аммония и иона аммония (MNH4Cl/MNH4+) CNH4+ - концентрация иона NH4+ в растворе, мг/дм3 V - объём раствора, дм3
- 2 ответа
-
- 1
-