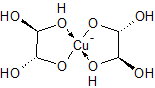-
Постов
34109 -
Зарегистрирован
-
Победитель дней
1124
Тип контента
Профили
Форумы
События
Весь контент yatcheh
-
Лопаются на раз-два.
-
PCl3 лучше во всех отношениях.
-
Амины легче аммиака окисляются. Разве что с гуанидином соль получится.
-
В заряженном аккумуляторе замечательно горит анодная масса - интеркалят лития в графите. Горит не хуже металла, и при контакте с водой воспламеняется. В разряженном аккумуляторе гореть нечему, кроме органического электролита, но у него весьма высокая температура вспышки, и к тому же это - раствор тетрафторбората (или гексафторфосфата) лития, что тоже не способствует горению.
-
Ну, так намешайте оксида свинца с фосфором - тоже хорошо гореть будет. Перхлорат, как было отмечено выше, с фосфором должен взрываться, а не гореть. Походу вас развели как курортника в винном погребке в Ялте
-
или в уксусной. но в азотной надёжнее.
-
Чудес не бывает. Если он не растворим в воде, значит это не перхлорат. Мохбыть - основной перхлорат, или какой-нить хлорид-перхлорат...
-
Может и есть. Я не опирался ни на какие источники. Мне так ка-а-этся...
-
Какие тут рассуждения про pH? Всё просто до банального: 2Na2CO3 + H2O + Cl2 => 2NaHCO3 + NaCl + NaOCl Поскольку вода исчерпана, далее идёт реакция хлора с гипохлоритом: NaOCl + Cl2 => NaCl + Cl2O В сумме 2Na2CO3 + H2O + 2Cl2 => 2NaHCO3 + 2NaCl + Cl2O В вики не зря упомянут трубчатый реактор с перемешиванием, поскольку жидкой фазы нет. При чём тут ваше бла-бла-бла про pH? pH чего?
-
В принципе, возможно. Правда, конфигурация получается невыгодная термодинамически, так что, полимер тут вряд ли получится, будет хелат вида С гидроксилами в трансоидной конфигурации.
- 26 ответов
-
- 1
-

-
122/284 = 0.43 Т.е. безводного надо взять 46.7*0.43 = 20.1 г
-
Это весь ответ на всю вашу клоунаду. Бро, успокойся, ты - великий химик, ты всегда прав, а если ты не прав - то смотри пункт первый.
-
Реально - клоун! Бугагашеньки
-
Какая разница, длЯ чего она использовалась? Она производилась ПРОМЫШЛЕННО! Не надо передёргивать! ... потому что этого не может быть никогда! Вся рота не в ногу, один унтер в ногу! Если вам что-то кажется - перекреститесь! Это работает. Не смотря на то, что это вам не нравится. Ну, вот - работает! Вы с вашими потугами становитесь просто смешны! Ваше ЧСВ не просто зашкаливает - оно переходит всякие границы приличия. Вы не даже шулер - вы клоун!
-
Достаточно вытяжного короба над станком и вентилятор среднего давления на вытяжку. Полноценный шкаф влетит в копеечку, а оно вам надо?
-
Поздравляю вас соврамши! Хоть и "ограниченные", но - "промышленные" масштабы. Химическая энциклопедия вас устроит как источник? "Получают Сl2О пропусканием С12, разбавленного N2, над HgO или р-цией С12 с влажным Na2CO3." Я уже дал конкретный пример - закись хлора получают реакцией хлора с содой. Вы ляпнули, что это не работает, и теперь ужом вьётесь, лишь бы не признать свой ляп. Типичные ужимки шулера
-
В чём "хранить"? В заводском баллоне? За три года с ним ничего не будет. А в другой посуде его и не хранят. Нет, можно, конечно, некоторое время хранить его в дьюаре, но это же не три года. Бывает, автоклавы используют для этой цели (в том числе - самопальные), но опять же - это для оперативных нужд. Нацедили, в цех отнесли, за неделю использовали.
-
M(Na2SiO3*9H2O) = 284.2 г/моль M(SiO3) = 76.1 Значит 284.2 г девятиводного метасиликата натрия соответствует 76.1 г SiO3 Увеличение концентрации на 0.5 мг/л для 50 л воды соответствует 0.5*50 = 25 мг SiO3 Значит в 1 мл должно быть 25 мг SiO3, а в 500 мл = 25*500 = 12.5 г SiO3 Это количество соответствует 12.5/76.1*284.2 = 46.7 г девятиводного метасиликата натрия. Итого: на 500 мл воды надо взять 46.7 г Na2SiO3*9H2O. Не зкаморачиваясь - 50 г, это будет прибавка 0.53 мг/л - вполне терпимая точность, учитывая изрядную неопределённость состава т.н. девятиводного метасиликата реактивной чистоты.
-
Брехня Брехня Можно Например - в этой теме. Брехня
-
О ней было сказано только одно - что это промышленный способ получения закиси хлора. Вы начали возражать - что, мол, реакция не так идёт. Вам предоставили ссылку. После чего вы начали обсуждать не относящийся к делу вопрос о применении закиси хлора в промышленности. Это и называется - шулерство, подмена темы разговора, после того, как вы, любезный, облажались. Всё остальное ваше бла-бла-бла - банальная попытка "сохранить лицо". Успокойтесь! Никто на ваше лицо не покушается, так же, как никто не считает вас экспертом по всем вопросам. Вы регулярно метёте откровенную пургу, но с вами предпочитают не спорить, поскольку обыграть шулера невозможно. Шулеру - только канделябром по бакенбардам.
-
CH3COOH + KOH = CH3COOK + H2O n(KOH) = n(CH3COOH) ,где n - количество вещества (моль) C(CH3COOH) = n(KOH)/V(CH3COOH) ,где С - концентрация кислоты (моль/л), V - объём раствора кислоты (л) C(CH3COOH) = 13.7/1000*0.1/(10/1000) = 0.137 моль/л 13.7/1000 - это объём раствора KOH, выраженный в литрах 0.1 - концентрация KOH в моль/л 10/1000 - это объём раствора кислоты, выраженный в литрах
- 3 ответа
-
- 1
-

-
Это гелий-4. При атмосферном давлении он не кристаллизуется при любой, как угодно низкой температуре, т.к. существует в виде квантовой жидкости (конденсат Бозе-Эйнштейна, благодаря нулевому спину ядра). В твёрдом виде его можно получить только при 25 атм. А вот гелий-3, наоборот, при нормальном давлении в квантовую жидкость не переходит. Образование квантовой жидкости при плавлении гелия-3 обнаружено при давлении 35 атм. По-видимому, из-за образования гелиевых "фононов" - слабосвязанных пар с суммарным нулевым спином.
-
Походу, на тяжёлые перешёл...
-
Не получится. Хелаты с медью образуют только 1,2-диолы, а тут 1,3. И уж тем более - никакого полимера не будет.
- 26 ответов
-
- 1
-

-
Ещё один пример самурайского мухлежа. Начал с того, что "реакция идёт не так", а закончил перспективами промышленного применения закиси хлора. Господа! Следите за руками! Самурай - шулер.