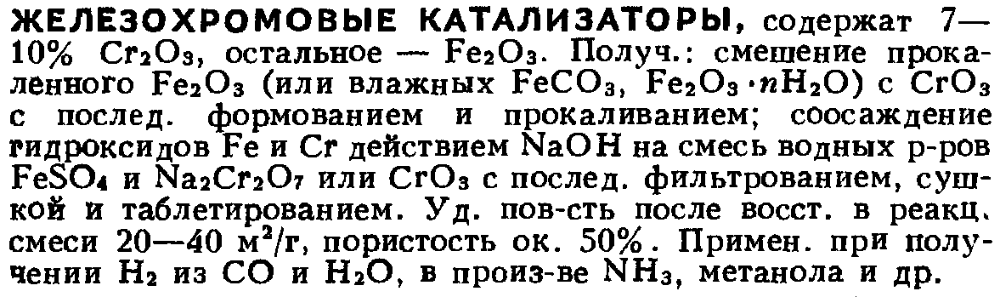-
Постов
2239 -
Зарегистрирован
-
Посещение
-
Победитель дней
15
Тип контента
Профили
Форумы
События
Весь контент pauk
-
Не пойдёт. В вашем списке сплошная пентозановщина. Даже не каждая древесина годится для получения целлюлозы. Ёлка - оптимальный вариант.
-
1s22s22p63s23p63d54s1 Хром (Cr), 4-й период, 6-я группа Переходные металлы (d-элементы) Степени окисления +2, +3, +6 (по-школьному)
-
Направление тока фигня, главное амплитуда. От 220 вольт горшок будет подпрыгивать вдвое выше, чем от 110.
-
О возможности производства бездымного пороха на целлюлозе из деревяхи известно давно. Все необходимые исследования были выполнены ещё при царе Горохе. Наверное, дело упирается в рентабельность. Дешевле купить хлопок у узбеков, чем валить ели в Сибири. С 2023 года предприятия Ростеха приступили к промышленному производству порохов из древесной целлюлозы. https://www.kommersant.ru/doc/6633988
-
Ничего из этого не выйдет. Дураков работа любит. Фундаментальный закон человеческой природы.
- 22 ответа
-
- евгеника
- гражданский долг
-
(и ещё 1 )
C тегом:
-
Надувается несколько больших воздушных шаров типа зондов и связывается в пучок. Потом из фермерского говномёта на них набрызгивается толстый слой цементного раствора. После затвердевания раствора воздух из шаров стравливается. Получается оригинальная конструкция типа термитника. В ней прорубают двери и окна. Изба готова.
-
5| P2H4 + 8H2O - 14e- = 2H3PO4 + 14H+ 14| MnO4- + 8H+ + 5e- = Mn2+ + 4H2O ----------------------------------------------------------------------------- 5P2H4 + 40H2O + 14MnO4- + 112H+ = 10H3PO4 + 70H+ + 14Mn2+ + 56H2O 5P2H4 + 14MnO4- + 42H+ = 10H3PO4 + 14Mn2+ + 16H2O 5P2H4 + 14KMnO4 + 21H2SO4 = 10H3PO4 + 14MnSO4 + 7K2SO4 + 16H2O
- 1 ответ
-
- 1
-

-
А шо тут непонятного? Мужик идёт раком. Спереди ноги в красных щиблетах, сзади руки - в чёрных. Остальное бутафория.
-
Ребяты! Всё не так! Формула буры Na2B4O7*10H2O Формула борной кислоты H3BO3 Молярная масса буры 381,28 Молярная масса борной кислоты 61,83 Реакция: Na2B4O7*10H2O + H2SO4 → 4H3BO3 + Na2SO4 + 5H2O Пропорция: 381,28 --- 4*61,83 20 ------- х х = 4*61,83*20/381,28 = 12,97 г В задании масса буры задана числом 20 (две значащие цифры) Столько же значащих цифр оставляем в ответе: 13 г
-
Железо и медь проявляют каталитическую активность в процессах гидрирования. Но это не надо воспринимать буквально, типа нарубил проволоки, вот тебе и катализатор. При таком подходе к делу результат в большинстве случаев будет нулевым. Катализатор должен быть приготовлен специальным образом (раздроблен или нанесён тем или иным способом на инертный носитель с высокоразвитой поверхностью вместе с модифицирующими добавками или без них, активирован перед использованием и т. п.). Действие катализаторов не является универсальным: один и тот же катализатор может быть высокоэффективным при гидрировании одного вещества (или группы веществ) и оказаться совершенно неактивным для гидрирования других. Также на селективность процесса влияют условия - температура, давление, время контакта и т. д. На форуме есть тема о дегидрировании спирта на медном катализаторе. Советую вам обратить внимание на трёхтомный капитальный справочник Ройтера по каталитическим свойствам веществ, упоминаемый в той теме. Он содержит общее описание каталитической активности в различных процессах практически для всех элементов, а также обзор каталитических реакций для нескольких тысяч веществ со ссылками на источники. Не исключено, что отыщется и нужное вам. Полезно ещё глянуть следующие издания: Мэкстед Э. - Катализ и его промышленное применение (1936) Беркман С. и др. - Катализ в неорганической и органической химии (в 2-х книгах, 1949) Пахомов Н. А. - Научные основы приготовления катализаторов (2011) Первые два издания из этого списка хоть и древние, зато капитальные. Всё это есть в интернете. Краткая характеристика (состав, способ приготовления, применимость) различных катализаторов хорошо изложена в Химическом Энциклопедическом Словаре (1983). Вот для примера несколько фрагментов из него:
-
Можно попытаться концентрированным раствором щёлочи. Жидкое средство "Крот" скорее всего не поможет, в нём порядка 15% щёлочи, а это маловато будет. В книжке Чалого "Гидроокиси металлов" описано растворение различных модификаций гидроокиси и оксогидроокиси алюминия в 12 н растворе NaOH (это очень большая концентрация, на грани насыщенного раствора). Можно также попробовать конц. серную кислоту. Всё это только мои соображения, результат не гарантируется.
-
Счастливое у вас детство было. А вот меня родители гнали веником по джопе.
-
СПАЯТЬ НЕЛЬЗЯ ВЫКИНУТЬ. Вот и чеши репу, где поставить запятую. Я предлагаю ничего не делать, а использовать колено по назначению, пока не треснет. Задолбали с этим ИИ. В каждую бочку затычка.
-
Если у вас действительно тетранатриевая соль, то получится. Она на нижней строчке этой таблицы (Na4Y). Чтобы приготовить 40%-ный раствор, на каждые 60 г воды надо брать 40 г этой соли.
-
Трилоном Б обычно называют дигидрат динатриевой соли ЭДТА. У меня на полке стоит баночка именно с таким названием. Возможно, это же название применяется и по отношению к тетранатриевой соли ЭДТА (в литературе по аналитике приводится его формула в виде гидрата с 4 молекулами воды). В таком случае, приготовить его 40%-ный раствор вполне возможно. Вот таблица растворимости различных натриевых солей ЭДТА:
-
Трилон Б - это дигидрат динатриевой соли ЭДТА. Его растворимость в воде (если вики не врёт): 10,5 г на 100 г. При такой растворимости 40%-ный раствор приготовить не удастся. Что за рецептура, если не секрет?
-
Сборников задач и упражнений по химии на просторах интернета столько, что застрелиться и не встать. Вот эти более-менее подходят для уровня 9 класса: А эти сборники посолиднее, с прицелом на вузы и университеты: Эти - с прицелом на олимпиады:
-
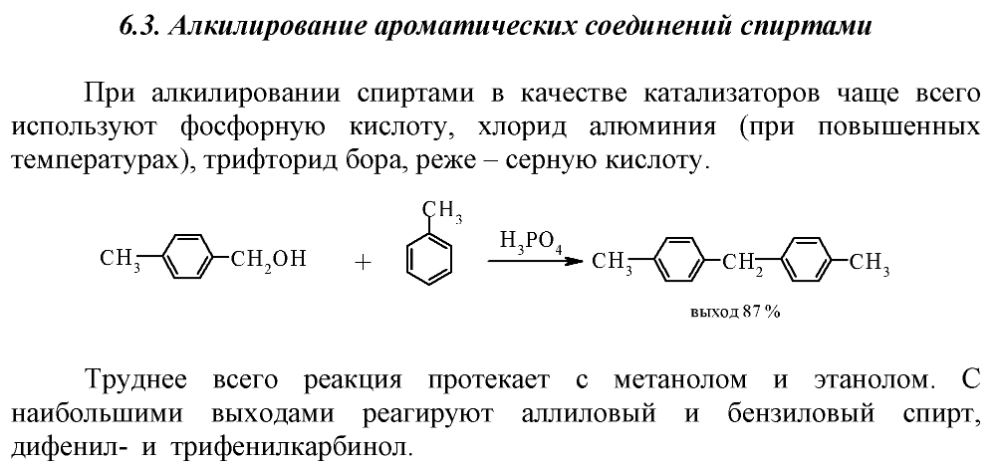
Обо всём по порядку: C6H4(CH3)2 + H2 → C6H5CH3 + CH4 (гидрогенолиз, катализатор Ni или Pt) Если проводить эту реакцию на Ni или Pt при умеренных условиях, то гидрируется бензольное кольцо (реакция гидрогенизации), а если проводить её с этими же катализаторами в более жёстких условиях, то происходит раскрытие цикла. Для гидрогенолиза с сохранением ароматического ядра нужны другие катализаторы и весьма жёсткие условия. Но я не уверен, что гидрогенолизом удастся добиться частичного деметилирования ксилола с получением толуола, как в вашей схеме. Скорее всего, бензольное кольцо будет ободрано подчистую. Зато существует способ каталитического диспропорционирования толуола в бензол и ксилол, что может пригодиться для вашей схемы. Обо всём этом можно прочитать в учебнике Лебедева по технологии основного органического и нефтехимического синтеза (в нём приведён пример гидрогенолиза толуола, так как он имеет промышленное значение; более лохматые гомологи бензола обдираются догола легче, я считаю): C6H4(CH3)2 + C2H4 → C6H5CH3 + C3H8 (реакция деалкилирования с этиленом) Деалкилирование с этиленом - это бред, я считаю. Из ниоткуда появились два лишних атома водорода. C6H6 + CH3OH → C6H5CH3 + H2O Так можно? Алкилирование ароматики спиртами возможно. Пример из учебного пособия Российского госуниверситета нефти и газа им. Губкина: Но применение этого метода ограничено. Тот же Лебедев пишет в своей книжке:
-
Вот статья про фенол из справочника Лазарева и Левиной: Вредные вещества в промышленности, т. 1, стр. 403-406 (1976).djvu
-
Опасности следующие: 1) отравление при попадании внутрь; 2) отравление при вдыхании паров; 3) ожоги кожных покровов. 1 - крайне нежелательно, можно получить тяжёлое поражение вплоть до летального исхода, но на практике вряд ли найдутся желающие кушать фенол. 2 - тоже нежелательно, но если речь идёт о лаборатории, то достаточно иметь вытяжку или хотя бы хорошо проветриваемое помещение (в случае разовой работы). 3 - это довольно опасный фактор, которым не следует пренебрегать; как минимум нужны перчатки, а лучше ещё и халатик/костюмчик в дополнение к ним. В лабораториях обычно не занимаются выковыриванием в камень слежавшегося фенола из банки, а просто расплавляют его на водяной бане и отливают нужное количество. При этом надо действовать аккуратно, дабы не пролить его на себя. Чтобы не расслабляться, почитайте на ночь следующий ужастик:
-
Относительно первой строчки из этого списка: я тоже категорически не воспринимаю возможность такой реакции. Непонятно, как может уживаться друг с другом парочка H2SO4/Na2SO3. Писали бы тогда уж SO2↑. А ещё эта реакция одним махом превращает всю многотрудную работу золотоизвлекателей в мартышкин труд. Предположим далее, что авторы этого "открытия" имели ввиду не растворение, а сплавление с гидросульфатом натрия. Но тогда среди продуктов реакции тем более не может быть Na2SO3, т. к. при нагревании он ещё и диспропорционирует.